
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:K+、NH4+、SO42-、NO3- | |
| B. | 0.1 mol/L NaAlO2溶液:Fe3+、H+、Cl-、SO42- | |
| C. | 与铝反应产生大量气体的溶液:Na+、K+、CO32-、NO3- | |
| D. | 使甲基橙试液显黄色的溶液:Fe2+、Mg2+、NO3-、Cl- |
分析 A.$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液,显酸性;
B.NaAlO2溶液显碱性;
C.与铝反应产生大量气体的溶液,为酸或强碱溶液;
D.使甲基橙试液显黄色的溶液,可能显酸性或碱性.
解答 解:A.$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液,显酸性,该组离子之间不反应,可大量共存,故A正确;
B.NaAlO2溶液显碱性,不能大量存在H+,且与Fe3+发生相互促进水解反应,不能共存,故B错误;
C.与铝反应产生大量气体的溶液,为酸或强碱溶液,酸溶液中不能大量存在CO32-,故C错误;
D.使甲基橙试液显黄色的溶液,可能显酸性或碱性,碱性溶液中不能大量存在Fe2+、Mg2+,酸溶液中Fe2+、H+、NO3-发生氧化还原反应,不能共存,故D不选;
故选A.
点评 本题考查离子共存,为高频考点,把握习题中的信息及离子之间的反应为解答的关键,侧重考查复分解及氧化还原反应,注意隐含条件的挖掘和利用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
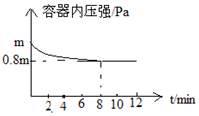 为氮及其化合物在工农业生产、生活中有着重要作用.在T℃时,将0.6mol H2和0.4mol N2置于容积2L的密闭容器中(压强为mPa)发生反应:N2(g)+3H2(g)?2NH3(g)△H<0 若保持温度不变,测得反应过程中容器内压强随时间变化如图所示:
为氮及其化合物在工农业生产、生活中有着重要作用.在T℃时,将0.6mol H2和0.4mol N2置于容积2L的密闭容器中(压强为mPa)发生反应:N2(g)+3H2(g)?2NH3(g)△H<0 若保持温度不变,测得反应过程中容器内压强随时间变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国明代医学家李时珍所著的医学名著是<<神农本草经>> | |
| B. | 麻黄碱是国际奥委会严格禁止使用的兴奋剂 | |
| C. | 毒品就是有毒的药品 | |
| D. | 表示非处方药,表示处方药 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳:ClO-+CO2+H2O=HClO+HCO3- | |
| B. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ | |
| C. | 从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- | |
| D. | Ca(ClO)2溶液中通入过量的SO2气体:ClO-+SO2+H2O═HClO+HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼、碳、氮、氟、硫、铁等元素的化合物广泛存在于自然界,回答下列问题:
硼、碳、氮、氟、硫、铁等元素的化合物广泛存在于自然界,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y既可是金属也可是非金属 | |
| B. | W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z | |
| C. | X、Z形成的某化合物在熔融状态下不导电 | |
| D. | WY2分子中既有非极性键又有极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=12的溶液中,K+、Cl-、HCO3-、Na+可以共存 | |
| B. | 水电离的c(H+)=1×10-3mol/L的溶液中:Na+、Fe3+、SO42-、Cl- | |
| C. | 由0.l moI/L BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH- | |
| D. | $\frac{{K}_{W}}{(O{H}^{-})}$=1×10-13mol/L 的溶液中:Ba2+、ClO-、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol NH3 | B. | 标准状况下22.4L He | ||
| C. | 100ml 10%的食盐水 | D. | 147g H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com