
以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
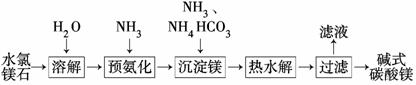
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6 mol/L,则溶液中c(Mg2+)=_____ ___。
___。
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为________。
(3)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO2 0.896 L,通过计算确定碱式碳酸镁的化学式。
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数________(填“升高”、“降低”或“不变”)。
解析:本题主要考查化学计算问题,意在考查考生综合判断和计算的能力。
(1)Ksp[Mg(OH)2]=c(Mg2+)·c2(OH-)=c(Mg2+)·(3.0×10-6)2=1.8×10-11,解得c(Mg2+)=2.0 mol/L。
(2)沉淀的成分为碱式碳酸镁,根据质量守恒关系可知滤液中得到的是NH4Cl,浓缩结晶后的固体物质化学式为NH4Cl。
(4)由碱式碳酸镁的化学式Mg(OH)2·4MgCO3·4H2O得镁含量为25.75%,而MgCO3中镁含量为28.57%,故产品中镁的质量分数升高。
答案:(1)2.0 mol/L
(2)NH4Cl
(3)n(CO2)= =4.00×10-2 mol,
=4.00×10-2 mol,
n(MgO)= =5.00×10-2 mol,
=5.00×10-2 mol,
n(H2O)=

=5.00×10-2 mol,
n(MgO)∶n(CO2)∶n(H2O)=
5.00×10-2∶4.00×10-2∶5.00×10-2=5∶4∶5,
碳式碳酸镁的化学式为Mg(OH)2·4MgCO3·4H2O。
(4)升高


科目:高中化学 来源: 题型:
下列运用与碳酸钠或碳酸氢钠能发生水解的事实无关的是( )
A.实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞
B.泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将其混合就可产生大量二氧化碳的泡沫
C.将稀盐酸逐滴加入到Na2CO3溶液中,开始无二氧化碳放出
D.可用碳酸钠与醋酸制取少量二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17,25 ℃时AgCl固体在下列四个选项中,溶解度最大的是( )
A.100 mL 0.01 mol/L KNO3溶液
B.100 mL 0.01 mol/L 盐酸
C.100 mL 0.01 mol/L AgNO3溶液
D.100 mL 0.01 mol/L KI溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,下列叙述正确 的是( )
的是( )
A.AgCl在饱和NaCl溶液中的Ksp和在纯水中的Ksp相同
B.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为浅黄色,说明Ksp(AgCl)<Ksp(AgBr)
C.将0.001 mol/L的AgNO3溶液滴入0.001 mol/L的KCl和0.001 mol/L的K2CrO4溶液中先产生Ag2CrO4沉淀
D.向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题;
(1)b、c、d中第一电离能最大的是________(填元素符号),e的价层电子轨道示意图为________。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为______;分子中既含有极性共价键、又含有非极性共价键的化合物是________(填化学式,写出两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是________;酸根呈三角锥结构的酸是________。(填化学式)
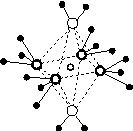
(4)e和c形成的一种离子化合物的晶体结构如图(a),则e离子的电荷为________。
(5)这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构[如图(b)所示]。

(a) (b)
该化合物中,阴离子为________,阳离子中存在的化学键类型有________;该化合物加热时首先失去的组分是________,判断理由是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第________周期第________族;S的基态原子核外有________个未成对电子;Si的基态原子核外电子排布式为________________________。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si____S | O2-____Na+ | NaCl____Si | H2SO4____HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是________________________________________________________________________
________________________________________________________________________。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在盛有KI溶液的试管中,滴入适量氯水充分反应后,再加四氯化碳振荡,静置后观察到的现象是( )
A.上层紫红色,下层接近无色
B.均匀、透明,紫红色
C.均匀、透明,无色
D.上层接近无色,下层紫红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com