
分析 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大,所以X是H元素;X、Z同主族,可形成离子化合物ZX,且Y原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G是短周期主族元素,所以G是Cl元素(不考虑稀有气体),据此解答.
解答 解:X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大,所以X是H元素;X、Z同主族,可形成离子化合物ZX,且Y原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G是短周期主族元素,所以G是Cl元素(不考虑稀有气体),
(1)Y是O元素,O原子有2个电子层,最外层电子数为6,处于第二周期第ⅥA族,
故答案为:第二周期第ⅥA族;
(2)非金属元素的非金属性越强,其相应的最高价含氧酸的酸性越强,这几种元素非金属性最强的是Cl元素,所以其最高价含氧酸的酸性最强的是高氯酸HClO4,
非金属性越弱,气态氢化物还原性越强,还原性最强的气态氢化物是硫化物 H2S,
故答案为:HClO4;H2S;
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有O3、Cl2、ClO2,故答案为:O3、ClO2;
(4)Na2O2中的化学键类型是离子键和共价键;Na2O2与水反应放出氧气的离子方程式为Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:离子键和共价键;Na2O2+2H2O=4Na++4OH-+O2↑;
(5)熔融状态下,Na的单质和FeCl2能组成可充电电池,反应原理为:2Na+FeCl2 $?_{充电}^{放电}$Fe+2NaCl,放电时,为原电池,活泼的金属钠为负极,发生氧化反应,
故答案为:Na;氧化.
点评 本题以元素推断为载体考查了元素化合物的性质,能正确判断元素是解本题的关键,注意元素化合物知识和元素周期律的综合应用.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na<Mg<Al<Si | B. | 热稳定性:HCl>H2S>PH3>AsH3 | ||
| C. | 酸性:H2SiO3<H2CO3<H3PO4<H2SO4 | D. | 碱性:KOH>NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的N2和CO所含分子数均为NA | |
| B. | 在标准状况下,22.4 L CH4与NH3的混合气体所含的电子数为10NA | |
| C. | 标准状况下,224 mL水含有的电子数为0.1 NA | |
| D. | 1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沉淀溶解后,生成深蓝色的配离子为[Cu(NH3)4]2+ | |
| B. | 向反应后的溶液中加入乙醇,有沉淀析出 | |
| C. | 在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3提供孤电子对 | |
| D. | 反应前后,Cu2+浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应AlCl3+4NaOH═NaAlO2+3NaCl+2H2O,可以设计成原电池 | |
| B. | Zn和稀硫酸反应时,加入少量CuSO4溶液能加快产生H2的速率 | |
| C. | 把Fe片和Cu片放入稀硫酸中,并用导线把二者相连,观察到Cu片上产生大量气泡,说明Cu与H2SO4能发生反应而Fe被钝化 | |
| D. | Zn-Cu原电池工作过程中,溶液中H+向负极作定向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解得到的汽油是纯净物 | B. | 煤就是碳,属于单质 | ||
| C. | 煤的气化是物理变化过程 | D. | 天然气是一种清洁的化石燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
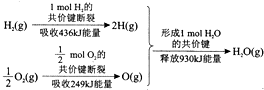
| A. | 1molH2(g)的共价键形成放出436kJ能量 | |
| B. | 氢气跟氧气反应生成水的同时吸收能量 | |
| C. | 1molH2(g)跟$\frac{1}{2}$molO2(g)反应生成1molH2O(g)释放能量245kJ | |
| D. | 1molH2(g)与$\frac{1}{2}$molO2(g)的总能量大于1molH2O(g)的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com