
【题目】一定条件下在一容积恒为2L的容器内发生反应:2A(g)+B(g)2C(g),已知起始投入4molA(g)和2molB(g),经2s后测得C的浓度为0.6mol/L,并且2s后各组分浓度不再改变,下列说法正确的是( )
A.2s内用物质A表示的平均反应速率为0.6mol/(L·s)
B.2s内用物质B表示的平均反应速率为0.6mol/(L·s)
C.2s后每有0.6mol的物质B生成,同时就有0.6mol物质C生成
D.反应前后的压强比为10:9
【答案】D
【解析】
A.2s内用物质C表示的平均反应速率为v(C)=![]() =
=![]() =0.3mol/(Ls),化学反应速率之比等于化学方程式计量系数之比,则v(A)=v(C)=0.3mol/(Ls),故A错误;
=0.3mol/(Ls),化学反应速率之比等于化学方程式计量系数之比,则v(A)=v(C)=0.3mol/(Ls),故A错误;
B.结合A项分析,v(B)=![]() v(C)=
v(C)=![]() ×0.3mol/(Ls)=0.15mol/(Ls),故B错误;
×0.3mol/(Ls)=0.15mol/(Ls),故B错误;
C.2 s后各组分浓度不再改变表示达到了化学平衡状态,0.6mol的物质B生成,表示逆反应方向,同时有0.6mol物质C生成,表示正反应方向,正逆反应速率之比为1∶1,不等于系数之比2∶1,与平衡状态不符,未处于平衡状态,故C错误;
D.根据反应,可列三段式,体积为2L,起始投入4molA(g)和2molB(g),2s后各组分浓度不再改变,说明反应达到平衡,有

根据相同条件下,气体物质的量之比等于压强之比,则有![]() ,故D正确;
,故D正确;
答案选D。


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案科目:高中化学 来源: 题型:
【题目】已知在101kPa、25℃条件下,2 mol氢气完全燃烧生成水蒸气放出484kJ的热量,下列热化学方程式正确的是( )
A.H2O(g)=H2(g)+![]() O2(l) △H=+242kJ/mol
O2(l) △H=+242kJ/mol
B.2H2 (g)+O2(g)=2H2O(l) △H=-484kJ/mol
C.H2(g)+![]() O2(g)=H2O(g) △H=-242kJ/mol
O2(g)=H2O(g) △H=-242kJ/mol
D.2H2(g)+O2(g)=2H2O(g) △H=+484kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
①![]() 分子中既含极性键又含非极性键
分子中既含极性键又含非极性键
②若![]() 和
和![]() 的电子层结构相同,则原子序数:
的电子层结构相同,则原子序数:![]()
③![]() 、
、![]() 、
、![]() 、
、![]() 熔点随相对分子质量的增大而升高
熔点随相对分子质量的增大而升高
④![]() 、
、![]() 、
、![]() 、
、![]() 分子中各原子均达到
分子中各原子均达到![]() 稳定结构
稳定结构
⑤固体熔化成液体的过程是物理变化,所以不会破坏化学键
⑥![]() 分子很稳定是由于
分子很稳定是由于![]() 分子之间能形成氢键
分子之间能形成氢键
⑦由于非金属性:![]() ,所以酸性:
,所以酸性:![]()
A.②⑤⑥⑦B.①③④⑤C.②④⑤D.③⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.邻二甲苯只有一种结构,能证明苯环中不存在碳碳单键和碳碳双键交替的结构
B.高聚物![]() 的单体可以通过乙烯和HCl加成制得
的单体可以通过乙烯和HCl加成制得
C.(CH3)2CH﹣CH=CH﹣C(CH3)3与氢气加成后的产物用系统命名法命名为2,2,5﹣三甲基己烷
D.完全燃烧一定质量的冰醋酸、葡萄糖混合物(以任意质量比混合),生成CO2和H2O的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.用石墨作阴极、铜作阳极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.0.01 mol·L-1NH4Al(SO4)2溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合:
NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3 ↓+NH3·H2O
C.含0.1 mol FeI2的溶液中滴加含0.1 mol Cl2的氯水:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.酸性KMnO4溶液与双氧水反应:2MnO4-+10H++3H2O2=2Mn2++3O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol·L-1Na2SO4溶液,下列叙述正确的是
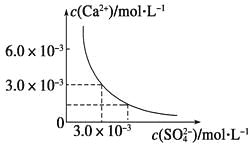
A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,铅蓄电池在放电过程中,负极质量增加,正极质量也增加
B.金属铝的冶炼流程为: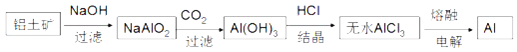
C.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀,但加热反应剧烈
D.一定条件下,使用催化剂能加快反应速率但不提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式书写或离子共存说法正确的是( )
A.在0.1molL-1 Na2CO3溶液中:Al3+、NH4+、SO42-、NO3-一定能大量共存
B.常温下,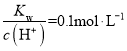 的溶液中,下列离子一定能大量共存:K+、Cl-、NO3-、Fe2+
的溶液中,下列离子一定能大量共存:K+、Cl-、NO3-、Fe2+
C.清洗锅炉时先用纯碱溶液浸泡的主要原因:CaSO4(s) + CO32-(aq)![]() CaCO3(s) + SO42-(aq)
CaCO3(s) + SO42-(aq)
D.向Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2+ + Al3+ + SO42- + OH- = BaSO4↓+ Al(OH)3↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com