
| A. | Fe2+ | B. | Mg2+ | C. | Al3+ | D. | NH4+ |
分析 加入过量的NaOH后,镁离子全部转化为Mg(OH)2沉淀.铝则转化成了偏铝酸根离子.氨转化为氨水,加热后生成氨气离开了溶液.铁离子全部转化为Fe(OH)2沉淀,被加热被氧化成Fe(OH)3,加入盐酸后氢氧化镁溶解生成氯化镁,氢氧化铁和盐酸反应生成氯化铁.
解答 解:依据题干信息分析判断可知,加入过量的NaOH后,镁离子全部转化为Mg(OH)2沉淀,铝则转化成了偏铝酸根离子,氨转化为氨水,加热后生成氨气离开了溶液,铁离子全部转化为Fe(OH)2沉淀,被加热被氧化成Fe(OH)3,加入盐酸后氢氧化镁溶解生成氯化镁,氢氧化铁和盐酸反应生成氯化铁;所以反应过程中金属离子大量减少的是Fe2+,故选A.
点评 本题考查离子之间的反应,明确阳离子与碱反应后的生成物的性质及生成物与酸的反应是解答本题的关键,注意亚铁离子易被氧化是学生解答中容易忽略的地方,题目难度中等.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥ | B. | ②③⑥ | C. | ②④⑤⑥ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
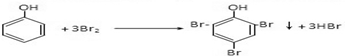 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L的盐酸 | B. | 0.01mol/L的醋酸溶液 | ||
| C. | c(H+)=10-3mol/L的溶液 | D. | c(OH-)=10-1mol/L溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
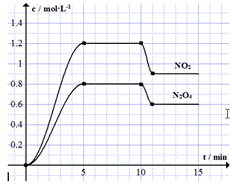 向容积固定为2L的密闭容器中充入9.6molNO和4.8molO2,发生如下反应:
向容积固定为2L的密闭容器中充入9.6molNO和4.8molO2,发生如下反应:| A. | 前5min反应的平均速率v(NO)=0.24mol•(L•min)-1 | |
| B. | T℃时反应①的化学平衡常数K=0.36 | |
| C. | 10min时改变反应条件可能是降低温度 | |
| D. | 若起始时向该容器中充入1.6mol NO2和4.0mol N2O4,T℃达到平衡时,NO2的物质的量浓度与图中5~10min的不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
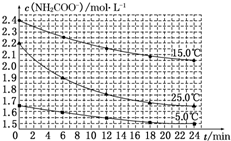 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
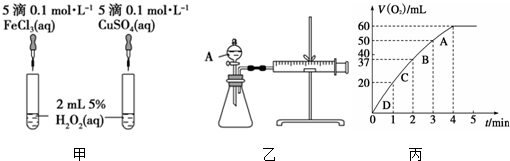
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯(乙酸):加饱和Na2CO3溶液,充分振荡静置后,分液 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 | |
| D. | 苯(苯酚):加浓溴水,静置后,过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com