
【题目】配制一定物质的量浓度的MgSO4溶液时,下列情况可能导致实际浓度偏高的是( )
A.称量时部分MgSO4吸收了水蒸气
B.定容时俯视容量瓶上的刻度线
C.洗涤后的容量瓶中有少量水珠
D.溶解过程中有少量的溶液溅出烧杯外
科目:高中化学 来源: 题型:
【题目】如图表示反应M(g)+P(g) ![]() nQ(g)的平衡体系中,Q的物质的量浓度c(Q)与温度T的关系(曲线上的点表示平衡状态)。下列有关该反应的描述错误的是( )
nQ(g)的平衡体系中,Q的物质的量浓度c(Q)与温度T的关系(曲线上的点表示平衡状态)。下列有关该反应的描述错误的是( )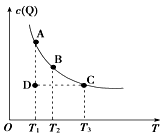
A.通过分析题图,该反应的正反应为放热反应
B.A状态与C状态的化学反应速率比较为v(A)<v(C)
C.在T1、D状态时,v正<v逆
D.在T2、B状态时,改变体积始终有v正=v逆 , 则n=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)A、B、C为三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Na+、K+、Cu2+ |
阴离子 | SO42-、OH- |
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了32g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示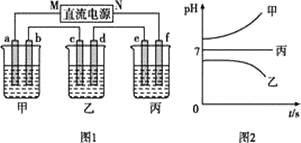
请回答下列问题:
(1)N为电源的(填“正”或“负”)极,电极b上发生的电极反应为。
(2)乙烧杯中的总反应为。
(3)计算电极e上生成的气体在标准状况下的体积为。
(4)丙烧杯要恢复到原来的状况,需要加入的物质和质量是。
(5)(Ⅱ)粗铜中一般含有锌、铁、银、金等杂质。在下图所示装置中,甲池的总反应方程式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O 接通电路一段时间后,精Cu电极质量增加了3.2g。在此过程中,甲池负极反应式 , 乙池硫酸铜溶液的浓度(填“变大”,“ 不变”,“变小”)。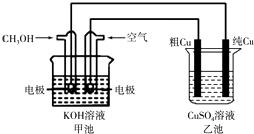
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应X(g)+3Y(g) ![]() 2Z(g) 达到平衡的标志是( )
2Z(g) 达到平衡的标志是( )
A. 单位时间内生成 1 molX,同时生成 3 molY
B. X, Y, Z的浓度相等
C. X, Y, Z的分子数比为1:3:2
D. 单位时间内生成 1 molX,同时生成2 molZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() 的系统命名法为2, 5-二甲基-4乙基己烷
的系统命名法为2, 5-二甲基-4乙基己烷
B.石油的裂化、煤的气化与液化都属于化学变化,而石油的分馏与煤的干馏都属于物理变化
C.总质量一定时,乙酸和葡萄糖无论以何种比例混合,完全燃烧消耗氧气的量相等
D.可用石蕊落液来鉴别乙二醇、葡萄糖、乙酸的水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各小题。
(1)铁是自然界分布最广的金属元素之一,在地壳中的质量约占5%左右。铁矿石的种类很多,重要的有磁铁矿石、赤铁矿石等。
①写出赤铁矿主要成分的化学式___________________;
②红热的铁能跟水蒸气反应,有一种产物是可燃性气体,则其化学反应方程式为_______;
(2)写出除去下列气体中的杂质(括号内的气体为杂质)所用的试剂,并写出除杂的化学方程式。
CO2 (HCl) ______________;化学方程式:_________________。
(3)1774年,瑞典化学家舍勒在研究软锰矿的过程中,制备出了一种黄绿色、有刺激性气味的气体。舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。写出实验室制取氯气的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清远市某校的化学兴趣小组经常做探究实验:
(一)为了探究一氧化氮能否被Na2O2完全吸收,设计了如下实验。装置如下(加热装置省略):

查阅资料所知:①2NO+Na2O22NaNO2
②酸性条件下,NO或NO2都能与KMnO4溶液反应生成NO3- 。
回答下列问题:
(1)仪器a名称:________。
(2)B瓶内装的物质是:____。
(3)若NO能被Na2O2完全吸收,E装置中的现象为___________________________。
(4)三颈烧瓶A中反应的化学方程式为_____________________________。
(5)C装置的作用是_____________________________________。
(二)实验室常用Na2SO3固体与浓硫酸反应制取SO2
(6)现有已制得SO2的饱和溶液,请设计一个简单实验,比较SO2与Fe2+ 还原性的
强弱(可供选择的试剂有:SO2的饱和溶液、FeCl2溶液、氯水、FeCl3溶液、KSCN
溶液、Ba(NO3)2溶液、BaCl2溶液)【要求:简要写出实验步骤、现象和结论】_________________________________________________________________。
(7)某同学测定部分变质的Na2SO3样品样品中Na2SO3的含量(已知在酸性条件下IO3-能将SO32-氧化为SO42-,自身还原为I-):
①用电子天平称取16.00g Na2SO3固体配成l00 mL溶液,取25.00mL于锥形瓶中,并加入几滴淀粉溶液。
②用0.1000 mol L-1酸性KIO3溶液(硫酸酸化)滴定,三次平行实验测得标准液的体积为24.00mL。则滴定终点时锥形瓶中产生的现象为________________________,写出与产生终点现象有关反应的离子方程式________________________________,样品中Na2SO3的质量分数为_________。(计算结果保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华文化源远流长、博大精深。从化学的视角看,下列理解不正确的是
A | B | C | D |
千淘万漉虽辛苦,吹尽黄沙始到金。刘禹锡《浪淘沙》诗句 |
司母戊鼎 |
侯德榜 |
瓷器(China) |
诗句中“淘”“漉”相当于分离提纯操作中的“过滤”。 | 属青铜制品,是我国古代科技光辉成就的代表之一。 | 我国化学工业的奠基人,主要成就: 侯氏制碱法,该碱指的是烧碱。 | 属硅酸盐产品,China一词又指“瓷器”,这反映了在西方人眼中中国作为“瓷器故乡”的形象。 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com