
| A. | 通式CnH2n+2 只表示一类物质 | |
| B. | C3H8光照下与氯气反应,最多能生成四种二氯代烃 | |
| C. | 戊烷有3种同分异构体 | |
| D. | 甲苯一氯取代物有3种 |
分析 A.CnH2n+2中H原子达到饱和,一定为烷烃;
B.先确定丙烷的一氯代物种类,然后用氯原子分别再取代1个H较为二氯丙烷;
C.戊烷存在正戊烷、异戊烷和新戊烷3种同分异构体;
D.“等效氢”原子的种类决定一氯代物的种类,甲苯分子中含有4种等效H.
解答 解:A.CnH2n+2表示的只能为烷烃这一类物质,故A正确;
B.C3H8为丙烷,丙烷不存在同分异构体,二氯丙烷中两个氯原子在同一C原子上有2种,在不同C原子上也有2种,所以二氯丙烷有4种结构,故B正确;
C.戊烷的同分异构体有: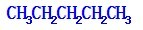 、
、 、
、 ,总共有3种结构,故C正确;
,总共有3种结构,故C正确;
D.甲苯中苯环上有邻间对三种一氯代物,甲基上氢还可被氯取代,故有4种一氯代物,故D错误;
故选C.
点评 本题考查了同分异构体、同系物的判断,题目难度不大,明确同分异构体的书写原则为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 用活性炭除去冰箱中的异味是发生了化学反应 | |
| B. | 航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成,它是一种新型无机非金属材料 | |
| C. | 碘是人体必需微量元素,所以要多吃富含碘化钾的食物 | |
| D. | 可以利用氯化铁溶液的酸性清除铜镜表面的铜锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3溶液与HNO3 | B. | Na2SO3固体与浓硫酸 | ||
| C. | 固体硫在纯氧中燃烧 | D. | 碳与热浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 编号 | 碱式滴定管读数 | 消耗体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 0 | 如图一 | |
| 2 | 0 | 23.97 | 23.97 |
| 3 | 0 | 24.03 | 24.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 用含有橙色的酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL 12mol•L-1盐酸溶液与足量MnO2共热,反应生成的气体分子数为0.3NA | |
| B. | 密闭反应容器中充入2mol SO2和1mol O2,充分反应转移电子数为4NA | |
| C. | 25.0g胆矾晶体溶于水配成1L溶液,所得溶液中阳离子数为0.1NA | |
| D. | 常温常压下,0.1mol C5H12所含有的共价键数目为1.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验 装置 图 | 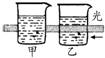 |  | 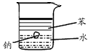 | 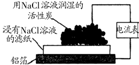 |
| 主要 现象 | 乙装置中有光亮通路,甲装置无明显现象 | 两试管中都有气泡产生,但乙比甲速率快 | 钠在水与苯层之间上下跳动,且有气泡产生 | 电流表指针发生偏转 |
| 实验 结论 | 乙装置中分散系为胶体,甲装置中分散系不是胶体 | 可验证FeCl3对H2O2分解反应有催化作用 | 证明密度ρ(苯)<ρ(钠)<ρ(水) | 电子从铝箔流出,经电流表、流到活性炭 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com