
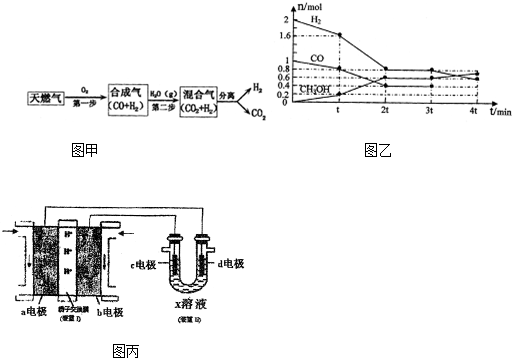
分析 (1)根据流程图可知甲烷不完全燃烧生成一氧化碳和氢气,依据热化学方程式的书写方法写出,标注物质聚集状态和对应焓变;
(2)①根据v=$\frac{△c}{△t}$进行计算;
②反应速率加快,而且在t的时刻,达平衡状态进行分析求解;
③平衡正向移动,是增加CO的量导致平衡正向移动;
(3)①由装置II中某电极上收集到标准状况下的气体V1mL时,另一电极增重mg可知,d极为阳极,而c极为阴极;
②根据阳极产生气体的体积,求出整个过程中转移电子的物质的量,然后铜的相对原子质量.
解答 解:(1)根据流程图可知甲烷不完全燃烧生成一氧化碳和氢气,1gCH4燃烧生成一氧化碳和氢气放热2.21kJ,16g甲烷燃烧生成二氧化碳和液态水放出热量16×2.21kJ=35.36KJ,16g甲烷为1mol,则甲烷不完全燃烧的热化学方程式为:2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-70.72 kJ•mol-1,
故答案为:2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-70.72 kJ•mol-1;
(2)①根据v=$\frac{△c}{△t}$=$\frac{\frac{2-1.6}{2}}{t}$=$\frac{1}{5t}$mol/(L•min),故答案为:$\frac{1}{5t}$mol/(L•min);
②反应速率加快,而且在t的时刻,达平衡状态,可能是反应受热或使用了催化剂,故答案为:反应受热或使用了催化剂;
③平衡正向移动,是增加CO的量导致平衡正向移动,所以图象为: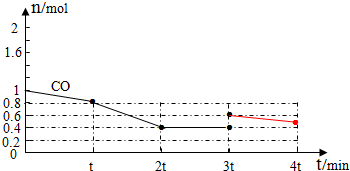 ,故答案为:
,故答案为: ;
;
(3)①由装置II中某电极上收集到标准状况下的气体V1mL时,另一电极增重mg可知,d极为阳极,而c极为阴极,所以与d极相连的a极为正极,原电池中阳离子向正极移动,b电极为负极是燃料发生氧化反应,反应方程式为:CH3OH-6eˉ+H2O=CO2+6H+,故答案为:a、CH3OH-6eˉ+H2O=CO2+6H+;
②整个过程中转移电子的物质的量为:$\frac{1{0}^{-3}×V1}{22.4}$,所以生成铜的物质的量为:$\frac{{V}_{1}}{11200}$,所以铜的相对原子质量的表达式为$\frac{11200m}{{V}_{{\;}_{1}}}$,故答案为:$\frac{11200m}{{V}_{{\;}_{1}}}$.
点评 本题考查化学反应热、平衡的移动和电化学的相关知识,综合性强,比较有难度.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序:C>D>B>A | |
| B. | 由B和C元素组成的化合物,可以既含有离子键,又含共价键 | |
| C. | 元素B、D、E分别与A形成的化合物中,熔沸点最高的是B与A形成的化合物 | |
| D. | 元素D与C形成的化合物在空气中长期放置不易变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +3NaOH→3C17H35COONa+
+3NaOH→3C17H35COONa+
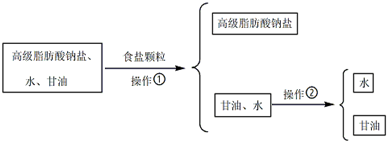
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n-3 | B. | n-1 | C. | n+5 | D. | n+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q G Z Y X | B. | Z X G Y Q | C. | G Y Z Q X | D. | G Y Q Z X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10 -10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | --- | -3 | -2 | |
| A. | X、Z、M的最简单离子半径大小为X>M>Z | |
| B. | X、Z、R的最高价氧化物的水化物之间不可两两相互反应 | |
| C. | R的氢化物比Q的氢化物沸点高、更稳定 | |
| D. | Y的氢化物的水溶液可用于雕刻玻璃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com