

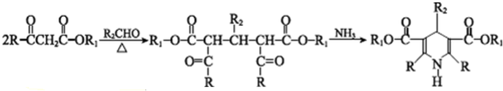
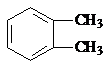 $→_{光}^{氯气}$
$→_{光}^{氯气}$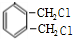 $→_{△}^{氢氧化钠溶液}$
$→_{△}^{氢氧化钠溶液}$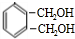 $→_{催化剂}^{氧气}$
$→_{催化剂}^{氧气}$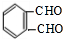 .
.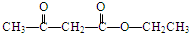 .
. .
.分析 A为苯的同系物,结合A的分子式与B的结构,可知A为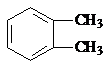
 ,
, 再碱性水解得
再碱性水解得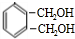 .
.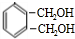 氧化得B,C可以连续发生氧化反应,结合C的分子式可知C为C2H5OH,则D为CH3CHO,E为CH3COOH,F为CH3COOC2H5,根据I的结构简式可知,H与氨气反应得到I,结合题中信息可知,H为
氧化得B,C可以连续发生氧化反应,结合C的分子式可知C为C2H5OH,则D为CH3CHO,E为CH3COOH,F为CH3COOC2H5,根据I的结构简式可知,H与氨气反应得到I,结合题中信息可知,H为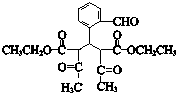 ,B和G反应生成H,结合G的分子式可知,G为
,B和G反应生成H,结合G的分子式可知,G为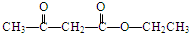 ,据此答题.
,据此答题.
解答 解:A为苯的同系物,结合A的分子式与B的结构,可知A为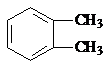
 ,
, 再碱性水解得
再碱性水解得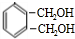 .
.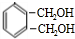 氧化得B,C可以连续发生氧化反应,结合C的分子式可知C为C2H5OH,则D为CH3CHO,E为CH3COOH,F为CH3COOC2H5,根据I的结构简式可知,H与氨气反应得到I,结合题中信息可知,H为
氧化得B,C可以连续发生氧化反应,结合C的分子式可知C为C2H5OH,则D为CH3CHO,E为CH3COOH,F为CH3COOC2H5,根据I的结构简式可知,H与氨气反应得到I,结合题中信息可知,H为 ,B和G反应生成H,结合G的分子式可知,G为
,B和G反应生成H,结合G的分子式可知,G为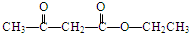 ,
,
(1)C→D的化学方程式是:2C2H5OH+O2 $→_{△}^{催化剂}$2CH3CHO+2H2O,
故答案为:2C2H5OH+O2 $→_{△}^{催化剂}$2CH3CHO+2H2O;
(2)根据上面的分析可知,A为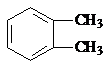
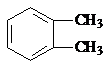
 $→_{△}^{氢氧化钠溶液}$
$→_{△}^{氢氧化钠溶液}$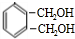 $→_{催化剂}^{氧气}$
$→_{催化剂}^{氧气}$ ,
,
故答案为: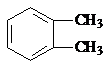
 $→_{△}^{氢氧化钠溶液}$
$→_{△}^{氢氧化钠溶液}$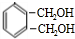 $→_{催化剂}^{氧气}$
$→_{催化剂}^{氧气}$ ;
;
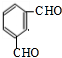
(3)根据上面的分析可知,G的结构简式为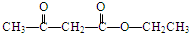 ,
,
故答案为: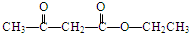 ;
;
(4)H为 ,
,
A.H中没有羧基,所以不能与NaHCO3反应,故A错误;
B.H中有酯基,能与NaOH反应,故B正确;
C.H中没有酚羟基,不能与FeCl3发生显色反应,故C错误;
D.H中有醛基,能与新制Cu(OH)2反应,故D正确,
故选BD;
(5)B为 ,根据条件①除苯环不含其他环,②不含碳碳双键,根据分子中不饱和度可知,分子中依然有两个醛基,③1H-NMR谱显示分子中有四种不同化学环境的氢原,则符合符合条件的B的同分异构体为
,根据条件①除苯环不含其他环,②不含碳碳双键,根据分子中不饱和度可知,分子中依然有两个醛基,③1H-NMR谱显示分子中有四种不同化学环境的氢原,则符合符合条件的B的同分异构体为 ,
,
故答案为: .
.
点评 本题考查有机物的推断、合成,正确理解题给信息是解本题关键,采用正推的方法进行分析解答,侧重考查学生的分析推理能力、知识迁移运用能力,难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
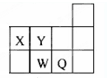
| A. | 元素X与元素Y可形成多种化合物 | |
| B. | 原子半径的大小顺序为:X>Y>W>Q | |
| C. | 还原性:W2-<Q- | |
| D. | 元素W的最高价氧化物对应水化物的酸性比Q的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
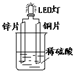
| A. | 锌片换成铁片,电路中的电流方向不变 | |
| B. | 铜电极的电极反应式为Cu2++2e-=Cu | |
| C. | 将硫酸换成柠檬汁,导线中仍有电子流动 | |
| D. | 装置中存在“化学能→电能→光能”的转换 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
| A. | M的原子半径比Q的大 | |
| B. | L、T形成的简单离子核外电子数相等 | |
| C. | R、L、M三种元素的金属性依次增强 | |
| D. | Q、T两元素的氢化物的稳定性为H nT>H nQ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
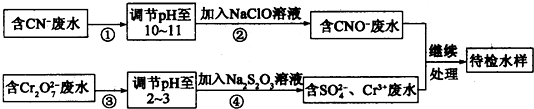
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
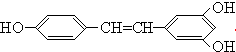 广泛存在于食物(例如桑葚、花生,尤其是葡萄)中,它可能具有抗癌性,下列关于白藜芦醇的说法错误的是( )
广泛存在于食物(例如桑葚、花生,尤其是葡萄)中,它可能具有抗癌性,下列关于白藜芦醇的说法错误的是( )| A. | 白藜芦醇属于三元醇,能与Na反应产生H2 | |
| B. | 能与NaOH反应,1mol该化合物最多能消耗NaOH 3mol | |
| C. | 能使FeCl3溶液显色 | |
| D. | 能与浓溴水反应,1mol该化合物最多能消耗溴6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含离子键的化合物称为离子化合物 | |
| B. | 化学键不仅存在于原子间,也存在于分子间 | |
| C. | 原子间通过极性键结合成分子的物质,一定是共价化合物 | |
| D. | 不同元素组成的多原子分子里的化学键一定是极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com