
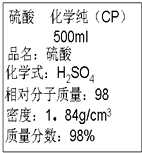
| A. | 该硫酸的物质的量浓度为9.2 mol•L-1 | |
| B. | 配制200 mL 4.6 mol•L-1的稀硫酸需取该硫酸25 mL | |
| C. | 该硫酸与等体积的水混合后所得溶液浓度为9.2 mol•L-1 | |
| D. | 该硫酸与等体积水混合后质量分数大于49% |
分析 A.根据c=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度;
B.根据溶液稀释前后溶质物质的量不变计算所需浓硫酸的体积;
C.硫酸和水的密度不同,等体积混合后体积不等于硫酸体积的2倍;
D.水的密度小于硫酸的密度,等体积混合所得溶液质量小于原硫酸溶液的2倍,稀释后溶质硫酸不变,结合质量分数定义,判断质量分数关系.
解答 解:A.浓H2SO4的物质的量浓度为:$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,故A错误;
B.配制200mL 4.6 mol•L-1的稀硫酸,溶液稀释前后溶质物质的量不变,则需要浓硫酸的体积为:$\frac{4.6mol/L×0.2L}{18.4mol/L}$=0.05L=50mL,故B错误;
C.硫酸和水的密度不同,等体积混合后体积小于硫酸体积的2倍,混合后物质的量浓度大于平均值,故C错误;
D.水的密度小于硫酸的密度,等体积混合所得溶液质量小于原硫酸溶液的2倍,稀释后溶质硫酸不变,根据质量分数=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%可知混合后溶液质量分数大于49%,故D正确;
故选D.
点评 本题考查溶液浓度的计算与判断,题目难度中等,注意硫酸的浓度越大,密度越大,明确物质的量浓度与物质质量分数的关系为解答关键,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
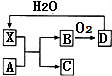 已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )| A. | X使蔗糖变黑的现象主要体现了X的强氧化性 | |
| B. | 若A为铁,则A与X在室温下不会反应 | |
| C. | 若A为碳单质,则将C通入少量的澄清石灰水中,溶液仍然澄清 | |
| D. | 工业上在高温、常压和使用催化剂的条件下,可以使B完全转化为D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
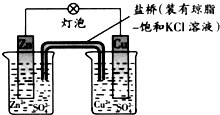
| A. | 正极反应为:Zn-2e-═Zn2+ | B. | 在外电路中,电子从铜片流向锌片 | ||
| C. | 负极发生还原反应 | D. | 盐桥中的K+移向CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝合金的大量使用,归功于人们用电解法从氧化铝中获取铝 | |
| B. | 铜的活动性比铁弱,故在海轮外壳装铜块减缓海轮腐蚀 | |
| C. | 用电镀厂的废水中直接灌溉农田,可提高水的利用率 | |
| D. | 甲醛溶液具有杀菌消毒的能力,故能用甲醛溶液浸泡食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10% | B. | 34% | C. | 72% | D. | 17% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com