
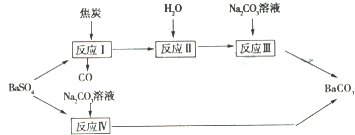
| c(SO42-) |
| c(CO32-) |
| c(SO42-)c(Ba2+) |
| c(CO32-)c(Ba2-) |
| KSp(BaSO4) |
| Ksp(BaCO3) |
| 1×10-10 |
| 5×10-9 |
| c(SO42-) |
| c(CO32-) |
| c(SO42-) |
| c(CO32-) |
| x |
| 2.0-x |


科目:高中化学 来源: 题型:
| A、乙烯使溴水退色是因为发生了加成反应 |
| B、糖类、油脂、蛋白质都可以水解 |
| C、只用水就可以鉴别四氯化碳、苯和乙醇 |
| D、石油分馏是物理变化、煤干馏是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+、Mg2+、Cl-、NO3-能大量共存于pH=0的溶液中 |
| B、1L浓度为l mol?L-1的NH4Cl溶液中含有NA个NH4+ |
| C、除去NO中混有的少量NO2,可将混合气体通过盛有水的洗气瓶,再用排空气法收集NO |
| D、不论是浓硝酸还是稀硝酸,与铜反应均体现出硝酸的酸性和强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1的NaCl溶液 |
| B、pH=6的醋酸用水稀释100倍 |
| C、pH=10的氢氧化钠溶液稀释1000倍 |
| D、0.1 mol?L-1的硫酸100 mL跟0.2 mol?L-1 NaOH溶液150 mL完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.7g金属铝变成铝离子时,失去的电子数为0.1NA |
| B、常温常压下,NA个氮分子的质量为28g |
| C、8g甲烷中所含氢原子数为2NA |
| D、100mL2mol/L氯化铝溶液中含Cl-离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
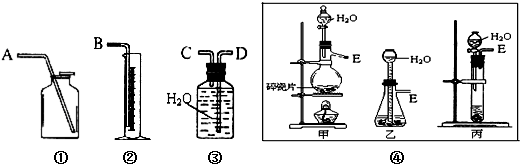
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com