
| A. | 生成40.0LN2(标况) | B. | 有0.250molKNO3被氧化 | ||
| C. | 共生成0.625mol氧化物 | D. | 共转移电子1.25mol |
分析 10NaN3+2KNO3═K2O+5Na2O+16N2↑中N元素化合价由-$\frac{1}{3}$、+5价变为0价,所以NaN3是还原剂、KNO3是氧化剂,N2既是氧化产物又是还原剂,根据反应方程式可知,每当生成16molN2,则氧化产物比还原产物多14mol,转移电子的物质的量为10mol,被氧化的N原子的物质的量为30mol,有2molKNO3被还原,现氧化产物比还原产物多1.75mol,则生成2molN2,转移电子的物质的量为1.25mol,被氧化的N原子的物质的量为3.75mol,据此分析解答.
解答 解:10NaN3+2KNO3═K2O+5Na2O+16N2↑中N元素化合价由-$\frac{1}{3}$、+5价变为0价,所以NaN3是还原剂、KNO3是氧化剂,N2既是氧化产物又是还原剂,根据反应方程式可知,每当生成16molN2,则氧化产物比还原产物多14mol,转移电子的物质的量为10mol,被氧化的N原子的物质的量为30mol,有2molKNO3被还原,现氧化产物比还原产物多1.75mol,则生成2molN2,转移电子的物质的量为1.25mol,被氧化的N原子的物质的量为3.75mol,
A.生成2molN2,在标准状况下的体积为44.8L,故A错误;
B.由反应可知,硝酸钾被还原,则被还原的硝酸钾的物质的量为2mol×$\frac{2}{16}$=0.25mol,故B错误;
C.由分析可知,反应生成2molN2,则生成的K2O为2mol×$\frac{1}{16}$=$\frac{1}{8}$mol,生成的Na2O为2mol×$\frac{5}{16}$=$\frac{5}{8}$mol,所以共生成0.5mol氧化物,故C错误;
D.转移电子的物质的量为0.25mol×(5-0)=1.25mol,故D正确;
故选D.
点评 本题考查氧化还原反应知识,侧重于氧化还原反应的计算,注意根据化合价的变化结合方程式判断氧化产物和还原产物的物质的量关系为解答该题的关键,题目难度中等.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗分离水与乙醇的混合物 | |
| B. | 用激光笔检验淀粉溶液的丁达尔现象 | |
| C. | 用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液 | |
| D. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
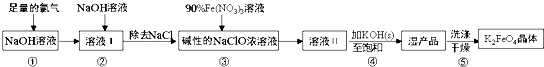
| A. | 步骤③中氧化剂与还原剂的物质的量之比为3:2 | |
| B. | 步骤④中Na2FeO4转变为湿产品是因为K2FeO4溶解度更小 | |
| C. | 步骤⑤中的洗涤剂可用CH3COOK和异丙醇来配制 | |
| D. | 配制90%Fe(NO3)3溶液必需的玻璃仪器有容量瓶、烧杯、量筒、玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
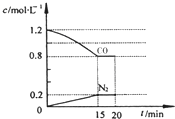 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
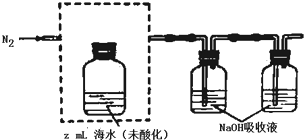
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焰色反应反映出物质的化学性质 | |
| B. | 所有金属及其化合物灼烧时火焰均有颜色 | |
| C. | 焰色反应均应透过蓝色钴玻璃观察 | |
| D. | NaCl与Na2CO3灼烧时火焰颜色相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂离子电池放电时电池反应为LiMO2+C6Li1-x═C6Li+Li1-xMO2 | |
| B. | 锂离子电池充电时电池内部Li+向负极移动 | |
| C. | 锂离子电池放电时电池内部电流从负极流向正极 | |
| D. | 锂离子电池充电时阳极反应为C6Li1-x+xLi++xe-═C6Li |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuFeS2既是氧化剂又是还原剂,硫元素既被氧化又被还原 | |
| B. | 每生成1molSO2转移6mol电子 | |
| C. | SO2既是氧化产物又是还原产物,FeS只是还原产物 | |
| D. | 每转移1.2 mol电子,有0.3 mol氧气被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com