
| A. | 自然界含硫化合物的分解和氧化 | B. | 火山喷发 | ||
| C. | 工厂排出的废气 | D. | 大量燃烧含硫燃料 |
科目:高中化学 来源: 题型:选择题
| A. | △H>0、△S>0 | B. | △H<0、△S<0 | C. | △H<0、△S>0 | D. | △H>0、△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
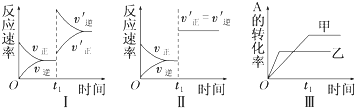
| A. | 图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响 | |
| B. | 图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响 | |
| C. | 图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高 | |
| D. | 图Ⅲ表示的是不同催化剂对平衡的影响,且甲的催化效率比乙高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入溴水溶液使溴水褪色 | B. | 通入品红溶液中,使品红褪色 | ||
| C. | 溶于水形成不稳定的亚硫酸 | D. | 与碱液反应生成亚硫酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度 | |
| B. | 当一个可逆反应达到平衡状态时,各组分浓度不变,v(正)=v(逆)=0 | |
| C. | 任何可逆反应的进程都有一定的限度,只是不同的反应限度不同 | |
| D. | 化学反应的限度可以通过改变条件而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油不能使溴的四氯化碳溶液褪色( ) | |
| B. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型不同 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| D. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
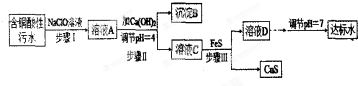
| l离子 | H+ | Cu2+ | Fe3+ | Fe2+ |
| 浓度/(mol•L-1) | 0.1 | 0.05 | 0.04 | 0.002 |
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | FeS | CuS |
| Ksp | 4.0×10-22 | 8.0×10-16 | 2.2×10-20 | 6.4×10-12 | 6.0×10-26 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com