
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z是第三周期电负性最大的元素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
分析 X的基态原子L层电子数是K层电子数的2倍,则X为C元素;Y的基态原子最外层电子排布式为nsnnpn+2,s能级只能容纳2个电子,则n=2,故Y为O元素;Z是第三周期电负性最大的元素,则Z为Cl;W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色,则W为Fe,据此解答.
解答 解:X的基态原子L层电子数是K层电子数的2倍,则X为C元素;Y的基态原子最外层电子排布式为nsnnpn+2,s能级只能容纳2个电子,则n=2,故Y为O元素;Z是第三周期电负性最大的元素,则Z为Cl;W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色,则W为Fe,
(1)W为Fe,位于元素周期表第四周期Ⅷ族,其基态原子的价电排布式为3d64s2,其基态原子最外层有2个电子,
故答案为:四;Ⅷ;2;
(2)同周期随原子序数增大,元素电负性增大,故C的电负性比O的小,CO2中,价层电子对数为2+$\frac{1}{2}$(4-2×2)=2,价层电子对模型为直线型,
故答案为:小;直线型;
(3)C元素和O元素的气态氢化物中,较稳定的是H2O,水能形成分子间氢键,故水的沸点较高,
故答案为:H2O;H2O;
(4)化合物XYZ2为COCl2,COCl2分子中所有原子均满足8电子构型,则该分子结构式为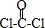 ,共价单键为σ键,共价双键中一个是σ键、一个是π键,所以该分子中σ键和π键个数之比为3:1,
,共价单键为σ键,共价双键中一个是σ键、一个是π键,所以该分子中σ键和π键个数之比为3:1,
故答案为:3:1;
(5)与铁同周期且导电性强于铁的元素为铜,价电子排布式为3d104s1,
故答案为:3d104s1.
点评 本题考查结构位置性质关系应用,涉及的知识点较多,要求学生熟悉元素周期表的结构和相关性质,注意分子间氢键是物质的沸点反常升高,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol•L-1 | |
| B. | 100 g硫酸溶液的物质的量浓度为18.4 mol•L-1,用水稀释到物质的量浓度为9.2 mol•L-1,需要水100 g | |
| C. | 配制一定物质的量浓度的氯化钾溶液:准确称取一定质量的氯化钾固体,放入到1000 mL的容量瓶中,加水1000 mL溶解,振荡摇匀 | |
| D. | 将10 g CuSO4溶解在90 g水中,配制质量分数为10%的CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1/KJ•mol-1 | I2/KJ•mol-1 | I3/KJ•mol-1 | I4/KJ•mol-1 | I5/KJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<C<B | |
| B. | 2.32g四氧化三铁与足量的B完全反应转移0.09mol电子 | |
| C. | C的气态氢化物无毒 | |
| D. | A元素在周期表中位于第二周期第VIA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③④ | C. | ②③⑤ | D. | ①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸雨就是指pH<5.6的雨水 | |
| B. | 利用丁达尔效应可以区别溶液与胶体 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 将某气体通入品红溶液中,品红溶液褪色,则该气体一定是SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com