
 S元素在自然界的转化对环境有着重要的影响.
S元素在自然界的转化对环境有着重要的影响.
分析 (1)①A可能是二氧化硫被氧化生成三氧化硫,也可能是二氧化硫与水反应生成亚硫酸;
②硫酸型酸雨对大理石石像腐蚀是硫酸与大理石的主要成份碳酸钙反应生成硫酸钙,化学方程式是H2SO4+CaCO3=CaSO4+H2O+CO2↑;
(2)①根据原子守恒、电荷守恒确定生成物;
②2mol的铁离子得到2mol的电子变成亚铁离子;
③依据四个反应分析判断产物;
(3)燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2中Cl、S元素的化合价均升高,根据得失电子守恒必定有一种物质得电子化合价降低,所以必含氧气;
(4)煤燃烧时加入生石灰(CaO)即可除去SO2,最后生成CaSO4,请写出该化学方程式:2SO2+2CaO+O2=2CaSO4;根据SO2~~CaO关系式分析求解.
解答 解:(1)①A可能是二氧化硫被氧化生成三氧化硫,也可能是二氧化硫与水反应生成亚硫酸,故答案为:H2SO3或SO3或H2SO3与SO3;
②硫酸型酸雨对大理石石像腐蚀是硫酸与大理石的主要成份碳酸钙反应生成硫酸钙,化学方程式是H2SO4+CaCO3=CaSO4+H2O+CO2↑,故答案为:H2SO4+CaCO3=CaSO4+H2O+CO2↑;
(2)①根据电荷守恒知,该微粒子是阴离子,再结合原子守恒知,该空为4SO42-;根据电荷守恒知,该微粒不带电荷,再结合原子守恒知,该空为2H2O,
故答案为:4SO42-;2H2O;
②2mol的铁离子得到2mol的电子变成亚铁离子,所双转移电子数为:2e-,故答案为:2e-;
③依据ⅰ至ⅳ四个离子方程式,分析判断最终的生成物为硫酸亚铁和硫酸,所以硫最终生成SO42-,故答案为:SO42-;
(3)燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2中Cl、S元素的化合价均升高,根据得失电子守恒必定有一种物质得电子化合价降低,所以必含O2
故答案为:O2;因氧化反应与还原反应同时发生,而Cl、S元素的化合价均升高,所以,有O2参与反应;
(4)煤燃烧时加入生石灰(CaO)即可除去SO2,最后生成CaSO4,请写出该化学方程式:2SO2+2CaO+O2=2CaSO4;
根据 SO2~~CaO
1kmol 56Kg
$\frac{10×1.6%}{32}$kmol m
m=0.028kg,
故答案为:2SO2+2CaO+O2=2CaSO4,0.028.
点评 本题考查了氧化还原反应,明确元素化合价再结合基本概念来分析解答即可,注意离子方程式要遵循电荷守恒、原子守恒、转移电子守恒,知道常见元素化合价,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 制取氢氧化铁胶体的化学方程式为FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3HCl | |
| B. | 亚硫酸在溶液中的电离方程式为H2SO3═2H++SO32- | |
| C. | NaHCO3水解的离子方程式为HCO3-+H2O═CO${\;}_{{3}_{\;}^{\;}}^{2-}$+H3O+ | |
| D. | 泡沫灭火器工作原理离子反应式为 Al3++3 HCO3-═3CO2↑+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双氧水被称为绿色氧化剂,是因为其还原产物为02,对环境没有污染 | |
| B. | 王水是浓盐酸和硝酸铵按体积比1:3配成的混合液.可以溶解Au、Pt | |
| C. | 氨水能够导电,说明氨气是电解质 | |
| D. | 新制备的氨水中存在三种分子和多种离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
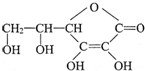 ,它的分子式是C6H8O6.在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有酸性.
,它的分子式是C6H8O6.在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有酸性.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机物A的化学式为C4H8O2,A与 有机物B、C、D、E有如下关系:装订线内请勿答题
有机物A的化学式为C4H8O2,A与 有机物B、C、D、E有如下关系:装订线内请勿答题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 中国著名药学家屠呦呦因制成了青蒿素而获得2015年度诺贝尔生理学或医学奖.青蒿素的结构如图,关于该物质的分类正确的是( )
中国著名药学家屠呦呦因制成了青蒿素而获得2015年度诺贝尔生理学或医学奖.青蒿素的结构如图,关于该物质的分类正确的是( )| A. | 单质 | B. | 有机物 | ||
| C. | 无机物 | D. | 有机高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ④⑤⑥⑦⑧ | D. | ③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的合成路线如下:
的合成路线如下:
 中含有的官能团名称为硝基,氟原子.
中含有的官能团名称为硝基,氟原子. 一定条件下形成聚合物的结构简式为
一定条件下形成聚合物的结构简式为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com