
| A. | 乙醇在电池的负极上参加反应 | |
| B. | 1mol CH3CH2OH被氧化转移6mole- | |
| C. | 随着反应的进行,正极附近的酸性减弱 | |
| D. | 电池放电过程中化学能转化成电能 |
分析 酸性乙醇燃料电池总反应为C2H5OH+3O2═2CO2+3H2O,负极乙醇被氧化生成CO2,电极反应式为C2H5OH-12e-+3H2O═2CO2+12H+,正极氧气得电子生成H2O,电极反应式为4H++O2+4e-═2H2O,结合原电池的工作原理解答该题.
解答 解:A、乙醇燃料电池中,乙醇在负极失电子参加反应,故A正确;
B、根据C2H5OH+3O2=2CO2+3H2O 转移12e-,可得1mol CH3CH2OH被氧化转移12mole-,故B错误;
C、该乙醇燃料电池用酸性电解质(H+)作溶剂,所以正极反应为O2+4e-+4H+=2H2O,随着反应的进行,H+不断被消耗,溶液酸性减弱,故C正确;
D、电池放电是原电池原理,化学能转化成电能,故D正确;
故选B.
点评 本题考查化学电源新型电池的工作原理,题目难度中等,解答本题的关键是能根据电池总反应判断正负极,并能写出电极反应式,为解答该题的易错点,注意把握.


科目:高中化学 来源: 题型:选择题
| A. | 英文的“中国”(China)又指“瓷器”,中国很早就应用化学技术制作陶瓷 | |
| B. | “四大发明”之一黑火药是由硫黄、硝石、木炭三种物质按一定比例配制的混合物 | |
| C. | 《淮南万毕术》中有“曾青得铁则化为铜”的记载,其含义是铁可从铜盐溶液中置换出铜 | |
| D. | 杜康用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O | B. | 8NH3+3Cl2═6NH4Cl+N2 | ||
| C. | 4NH3+6NO$?_{△}^{催化剂}$5N2+6H2O | D. | NH3+HCl═NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(O2)=0.01mol/(L•s) | B. | v(NO)=0.08mol/(L•s) | ||
| C. | v(H2O)=0.003mol/(L•s) | D. | v(NH3)=0.001mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
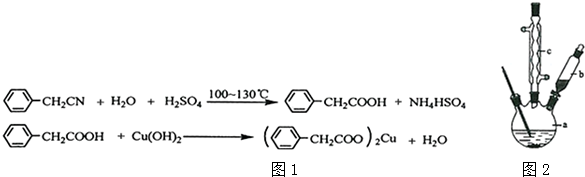
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
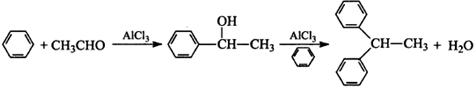
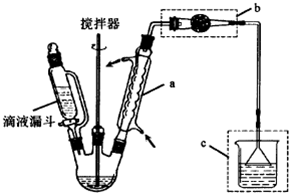
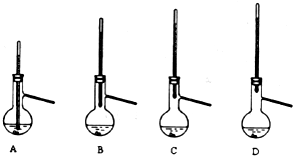
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应物质的性质是决定化学反应速率的主要因素 | |
| B. | 光是影响某些化学反应速率的外界条件之一 | |
| C. | 决定化学反应速率的主要因素是浓度 | |
| D. | 增大浓度、加热、加压或使用催化剂,都是加快反应速率的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
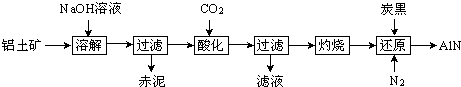
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入氮化铝样品的质量/g | 4.1 | 8.2 | 12.3 |
| 生成氨气的体积/L(标准状况) | 1.456 | 2.912 | 4.256 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com