
分析 (1)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度;
(2)依据配制溶液体积选择合适规格容量瓶,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积;
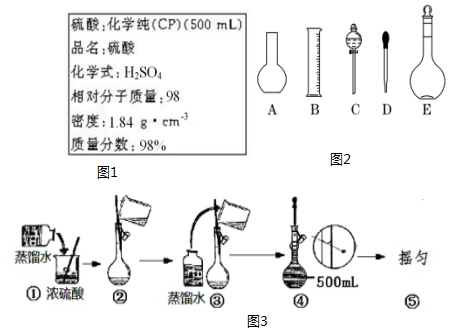
(3)根据配制一定物质的量浓度溶液的一般步骤分析解答需要的仪器和用不到的仪器;
(4)依据浓硫酸稀释、定容的正确操作;
(5)分析操作对溶质的物质量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(6)依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积.
解答 解:(1)质量分数为98%,密度为1.84g/mL的浓硫酸,物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L;
故答案为:18.4;
(2)配制490mL 4.6mol/L的稀硫酸,应选择500mL容量瓶,实际配制500mL溶液,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得V×18.4mol/L=500mL×4.6mol/L,解得V=125.0mL;
故答案为:125.0;
(3)用浓硫酸配制一定物质的量浓度稀硫酸,基本步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,用到的仪器:量筒、胶头滴管、烧杯、玻璃棒、500mL容量瓶,用不到的仪器:平底烧瓶、分液漏斗;还缺少的仪器:500mL容量瓶;
故答案为:AC;500mL容量瓶;
(4)浓硫酸稀释应将浓硫酸沿着烧杯壁缓缓注入水中;定容时,应平视刻度线,所以错误的操作为:①④;
故答案为:①④;
(5)A.未经冷却趁热将溶液注入容量瓶中,冷却后,溶液体积偏小,溶液浓度偏高,故A选;
B.容量瓶洗涤后,未经干燥处理,对溶质的物质的量和溶液体积都不产生成影响,溶液浓度不变,故B不选;
C.定容时仰视观察液面,导致溶液体积偏大,溶液浓度偏低,故C不选;
D.摇匀后发现液面低于刻度线继续加水定容,导致溶液体积偏大,溶液浓度偏低,故D不选;
故选:A;
(6)用配制好的4.6mol/L的稀硫酸溶液,再来配制50ml 1.4mol/L的H2SO4溶液,设需要硫酸的体积为V,依据溶液稀释过程中溶质的物质的量不变得:4.6mol/L×V=50ml×1.4mol/L,解得V=15.2mL;
故答案为:15.2.
点评 本题考查配制一定物质的量浓度的溶液及误差分析,明确配制原理及操作步骤是解题关键,注意容量瓶构造及使用方法和注意事项,注意误差分析的方法和技巧,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何条件下,16gCH4与18 g H2O所含有电子数均为10NA | |
| B. | 19g的H3O+离子中含有的电子数为11NA | |
| C. | 0.5mol/LH2SO4中的H+数为NA | |
| D. | 22.4 L的CO气体与1 mol N2所含的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白磷放在水中 | |
| B. | 酒精等易燃物应敞口放置且远离火源 | |
| C. | 氯酸钾、硝酸铵不要同可燃物混放,防爆炸 | |
| D. | 浓硫酸与固体氢氧化钠都需要密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和③ | B. | ③和④ | C. | ②和③ | D. | ②和⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解氯化镁溶液的阴极电极反应式:Mg2++2e-═Mg | |
| B. | 惰性电极电解饱和食盐水:2Cl-+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| C. | 醋酸与乙醇混合、浓硫酸催化加热:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | 硫酸铝和小苏打溶液混合:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.5 mol•L-1的Fe2(SO4)3 溶液中Fe3+的数目为NA | |
| B. | 室温下,pH=13的NaOH溶液中,OH-离子数目为0.1NA | |
| C. | 0.1 L 0.5 mol•L-1 CH3COOH溶液中含有的氢离子数目小于0.05NA | |
| D. | 电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com