

| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 244.8 |
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,甲3mL水配制溶液 | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL0.1mol.L-1KI溶液,振荡 | 溶液无变化 |
| 然后再滴入1滴1mol.L-1的H2SO4,从发振荡 | 溶液变蓝色 |
分析 (1)在氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物,氧化剂对应的产物是还原产物;
(2)根据物质的溶解度可以确定溶液获得晶体的方法;
(3)①根据硫代硫酸钠与碘酸钾的关系式计算碘酸钾的物质的量;
②酸性条件下,碘离子被氧气氧化生成碘单质;过量的碘离子易被空气氧化生成碘单质.
(4)①从第一份试液中滴加KSCN溶液后显红色,可知该加碘盐中含有Fe3+,反应:Fe3++3SCN-=Fe(SCN)3,Fe(SCN)3呈血红色;从第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色,可知有碘生成.这是因为由于“氧化性:IO3->Fe3+>I2”,加足量KI后,IO3-和Fe3+均能将I-氧化成I2,由此也可以知道该加碘盐添加KIO3;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.由此可知该加碘盐中不含KI;
②具有氧化性的离子为IO3-与具有还原性的离子为I-,发生氧化还原反应.
解答 解:(1)该反应中I元素化合价由0价变为+5价,Cl元素化合价由+5价变为-1价和0价,所以I2是还原剂,KClO3是氧化剂,KCl、Cl2是还原产物,故答案为:KCl、Cl2;
(2)碘酸钾的物质的量随着温度升高而增大,所以从碘酸钾溶液获得晶体可以采用降温结晶的方法,故答案为:降温结晶;
(3)①设碘酸钾的物质的量为x.
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O①; I2+2S2O3 2-=2I-+S4 O62-②,将方程式②×3+①得
IO3-+6H++6S2O32-=I-+3S4O62-+3H2O
1 6
x 2.0×10-3mol/L×0.01L
x=$\frac{2.0×10{\;}^{-3}mol/L×0.01L×1}{6}$=$\frac{1}{3}$×10-5mol,根据碘原子守恒知,碘元素的物质的量=$\frac{1}{3}$×10-5mol,所以碘元素含量是=$\frac{\frac{1}{3}×10{\;}^{-5}}{w×10{\;}^{-3}}$×100%=$\frac{0.01}{3w}$mol•kg-1,
故答案为:$\frac{0.01}{3w}$;
②酸性条件下,碘离子被氧气氧化生成碘单质,离子反应方程式为:4I-+4H++O2=2I2+2H2O;酸性条件下,过量的碘离子易被空气中氧气氧化生成碘单质,导致测定结果偏大,故答案为:4I-+4H++O2=2I2+2H2O;偏大,过量的I-会被空气中的O2氧化为I2.
(4)①某加碘盐可能含有KIO3、KI、Mg2+、Fe3+,用蒸馏水溶解,并加稀盐酸酸化后将溶液分为3份.从第一份试液中滴加KSCN溶液后显红色,可知该加碘盐中含有Fe3+,反应:Fe3++3SCN-=Fe(SCN)3,Fe(SCN)3呈血红色;从第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色,可知有碘生成.这是因为由于“氧化性:IO3->Fe3+>I2”,加足量KI后,IO3-和Fe3+均能将I-氧化成I2,由此也可以知道该加碘盐添加KIO3;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.由此可知该加碘盐中不含KI.
故答案为:Mg2+;
②第二份试液中加入足量KI固体后,反应的离子方程式为2Fe3++2I-=2Fe2++I2、IO3-+5I-+6H+═3I2+3H2O,
故答案为:2Fe3++2I-=2Fe2++I2、IO3-+5I-+6H+═3I2+3H2O.
点评 本题考查了氧化还原反应方程式的有关计算以及溶液成分的测定,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,题目难度不大.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 该溶液中K+、Fe2+、SCN-、Br-可以大量存在 | |
| B. | 和KI溶液反应的离子方程式:Fe3++2I-═Fe2++I2 | |
| C. | 和Ba(OH)2溶液反应离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | 1L0.1 mol•L-1该溶液和足量的Zn充分反应,生成11.2gFe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

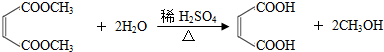 .
.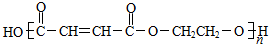 .
.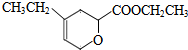 、
、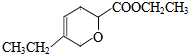 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
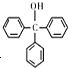 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的合成流程如图1所示.装置如图2所示
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的合成流程如图1所示.装置如图2所示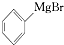 +H2O→
+H2O→ +M(OH)Br(碱式溴化镁)
+M(OH)Br(碱式溴化镁)| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、笨等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸已酯 | -34.6℃ | 212.6℃ | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,溶于乙醇、醚等多数有机溶剂 | |
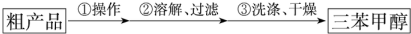
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
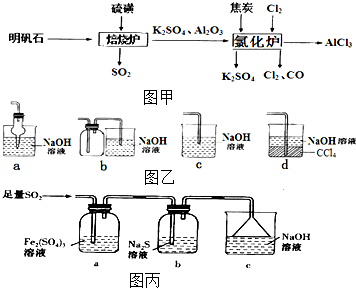 无水氯化铝是一种重要的化工原料,利用明矾石[K2SO4•A12(SO4)3•2A12O3•6H2O]制备无水氯化铝的流程如图甲:
无水氯化铝是一种重要的化工原料,利用明矾石[K2SO4•A12(SO4)3•2A12O3•6H2O]制备无水氯化铝的流程如图甲:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
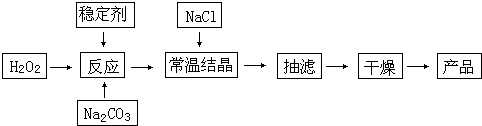
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下67.2 L乙烯所含的碳碳双键数与78 g苯所含的碳碳双键数 | |
| B. | 18g重水(D2O)与20g Ne含有相等的电子数 | |
| C. | 1mol CaC2与78 g Na2O2两种固体所含的阴、阳离子总数相等 | |
| D. | 在平衡体系PCl5(g)?PCl3(g)+Cl2(g)中加入一定量的37Cl2,一段时间后,37Cl存在于五氯化磷、三氯化磷和氯气这三种物质中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
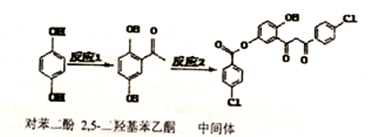
| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1mol该中间体最多可与11mol H2反应 | |
| C. | 2,5羟基苯乙酮能发生加成、氧化、还原、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com