
【题目】化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。
(1)键能也可以用于估算化学反应的反应热(ΔH)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ·mol-1) | 172 | 335 | 498 | X |
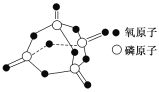
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构如图所示,则上表中X=________。
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的.”这个规律被称为盖斯定律.有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①已知:
C(石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol①
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ/mol②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599.2 kJ/mol③
则由C(石墨)和H2(g)反应生成1 mol C2H2(g)的焓变为__________________。
②已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出x kJ热量。已知单质碳的燃烧热为y kJ/mol,则1 mol C与O2反应生成CO的反应热ΔH为______________。
【答案】470 +226.8 kJ/mol -(5x-0.5y) kJ/mol
【解析】
(1)白磷燃烧的方程式为P4+5O2=P4O10,根据化学键的断裂和形成的数目进行计算;
(2)①可以先根据反应物和生成物书写化学方程式,根据盖斯定律计算反应的焓变,最后根据热化学方程式的书写方法来书写热化学方程式;
②首先判断碳的燃烧产物,然后依据反应热计算。
(1)白磷燃烧的方程式为P4+5O2=P4O10,1mol白磷完全燃烧需拆开6mol P-P、5mol O=O,形成12molP-O、4mol P=O,所以12mol×335kJ/mol+4mol×xkJ/mol-(6mol×172 kJ/mol+5 mol×498 kJ/mol)=2378.0kJ,解得x=470;
(2)①已知:①C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJmol-1;②2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJmol-1;③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H2=-2599kJmol-1;2C(s,石墨)+H2(g)=C2H2(g)的反应可以根据①×2+②×![]() -③×
-③×![]() 得到,所以反应焓变△H=2×(-393.5kJmol-1)+(-571.6kJmol-1)×
得到,所以反应焓变△H=2×(-393.5kJmol-1)+(-571.6kJmol-1)×![]() -(-2599kJmol-1)×
-(-2599kJmol-1)×![]() =+226.7kJmol-1;
=+226.7kJmol-1;
②碳在氧气中燃烧,氧气不足发生反应2C+O2![]() 2CO,氧气足量发生反应C+O2
2CO,氧气足量发生反应C+O2![]() CO2;3.6g碳的物质的量为
CO2;3.6g碳的物质的量为![]() =0.3mol,6.4g的氧气的物质的量为
=0.3mol,6.4g的氧气的物质的量为![]() =0.2mol,n(C):n(O2)=3:2;介于2:1与1:1之间,所以上述反应都发生.令生成的CO为xmol,CO2为ymol;根据碳元素守恒有x+y=0.3,根据氧元素守恒有x+2y=0.2×2,联立方程,解得x=0.2,y=0.1;单质碳的燃烧热为Y kJ/mol,所以生成0.1mol二氧化碳放出的热量为0.1mol×Y kJ/mol=0.1YkJ,因此生成0.2molCO放出的热量为XkJ-0.1YkJ。由于碳燃烧为放热反应,所以反应热△H的符号为“-”,故1mol C与O2反应生成CO的反应热△H=-
=0.2mol,n(C):n(O2)=3:2;介于2:1与1:1之间,所以上述反应都发生.令生成的CO为xmol,CO2为ymol;根据碳元素守恒有x+y=0.3,根据氧元素守恒有x+2y=0.2×2,联立方程,解得x=0.2,y=0.1;单质碳的燃烧热为Y kJ/mol,所以生成0.1mol二氧化碳放出的热量为0.1mol×Y kJ/mol=0.1YkJ,因此生成0.2molCO放出的热量为XkJ-0.1YkJ。由于碳燃烧为放热反应,所以反应热△H的符号为“-”,故1mol C与O2反应生成CO的反应热△H=-![]() =-(5X-0.5Y)kJ/mol。
=-(5X-0.5Y)kJ/mol。


科目:高中化学 来源: 题型:
【题目】现有硫酸钠和碳酸钠混合溶液10.0 mL,加入足量氯化钡溶液,充分反应后,经过滤、洗涤和干燥,得到白色沉淀1.451 g。将沉淀与过量盐酸反应,得到112 mL 二氧化碳气体(在标准状况下)。求原混合溶液中硫酸钠和碳酸钠的物质的量浓度分别是多少?________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将7.68g铜与50mL一定浓度的硝酸恰好完全反应,收集到标准状况下4.48L气体。
请回答:
(1)NO的体积为__L,NO2的体积为__L;
(2)被还原的硝酸的物质的量是__mol;
(3)硝酸的物质的量浓度是__mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g)![]() 2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是
2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是
①a、b、c应满足的关系是4a+c=2b
②平衡时HBr为ax mol
③a、b、c应满足的关系是a+b=c
④平衡时HBr为![]() x mol
x mol
A. ① B. ①② C. ①④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知浓硫酸和木炭粉在加热条件下反应:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,根据如图回答问题:
CO2↑+2SO2↑+2H2O,根据如图回答问题:
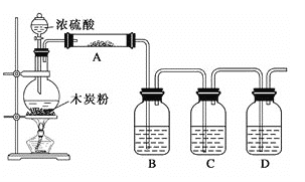
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气?__。
(2)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
①A中加入的试剂是___,作用是___;
②B中加入的试剂是___,作用是___;
③C中加入的试剂是___,作用是___;
④D中加入的试剂是___,作用是___。
(3)实验时,C中应观察到的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH- △H>0,下列叙述正确的是
H++OH- △H>0,下列叙述正确的是
A. 向水中加入少量固体硫酸氢钠,c (H+)增大,Kw不变
B. 向水中加入氨水,平衡逆向移动,c (OH-)降低
C. 向水中加入金属钠,平衡逆向移动,c (H+)减小
D. 将水加热,Kw增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
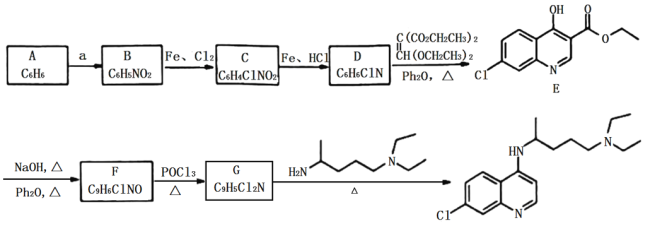
【题目】“磷酸氯喹”是抗击新型冠状病毒的潜在药物,其合成路线如下:
已知: 
![]()

(1)A是一种芳香烃,试剂a为:____________________。
(2)B反应生成C的反应化学方程式为____________________。
(3)由C生产D和由F生成G的反应类型分别为__________、___________。
(4)D的结构简式为_________。
(5)E中含氧官能团的名称为________。
(6)I与E互为同分异构体,且具有完全相同的官能团,符合下列条件的I有____种。(不考虑立体异构)
①分子结构中含有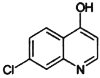 ;②分子中环状结构上只有三个取代基。写出其中任意两种结构简式____、______。
;②分子中环状结构上只有三个取代基。写出其中任意两种结构简式____、______。
(7)有机物J(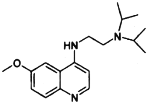 )是治疗血吸虫病的药物,参照上述
)是治疗血吸虫病的药物,参照上述![]() 的合成路线,设计由4-甲氧基苯氨(
的合成路线,设计由4-甲氧基苯氨( )和N,N-二异丙基乙二胺(
)和N,N-二异丙基乙二胺(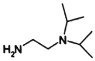 )为起始原料制备有机J的合成路线_______________________(无机试剂任意选用)。
)为起始原料制备有机J的合成路线_______________________(无机试剂任意选用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
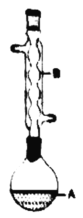
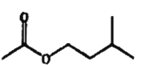
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:

![]()
 +H2O
+H2O
物质 | 相对分子质量 | 密度 | 沸点/℃ | 水中溶解性 |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
实验步骤:
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50min,反应液冷至室温后倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水![]() 固体,静置片刻,过滤除去
固体,静置片刻,过滤除去![]() 固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。回答下列问题:
固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。回答下列问题:
(1)仪器A的名称是:________
(2)在洗涤操作中,第一次水洗的主要目的是:________;第二次水洗的主要目的是:________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗上口倒出
b.直接将乙酸异戊酯从分液漏斗下口放出
c..先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:________________。
(5)实验中加入少量浓硫酸的目的是:________________。
(6)在蒸馏操作中加热一段时间发现忘加碎瓷片,应采取的正确操作是:________。(请用文字描述)
(7)本实验的产率是:________(
a.30% b.40% c.50% d.60%
(8)在进行蒸馏操作时,若从110℃便开始收集馏分,会使实验的产率偏________(填“高”或“低”),其原因是_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com