
在常压和500 ℃条件下,等物质的量的Ag2O、Fe(OH)3、NH4HCO3、NaHCO3,完全分解,所得气体体积依次为V1、V2、V3、V4。体积大小顺序正确的是( )
A.V3>V2>V4>V1 B.V3>V4>V2>V1
C.V3>V2>V1>V4 D.V2>V3>V1>V4
科目:高中化学 来源: 题型:
已知一定条件下合成氨反应:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施。
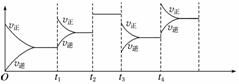
t1____________;t2______________;t3______________;
t4____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
芳香酯类化合物A、B互为同分异构体,均含C、H、O三种元素。相同状况下,A、B蒸气对氢气的相对密度是97,分子中C、H原子个数相同,且C、H原子数之和是O原子数的5倍。
(1)A的分子式是________________。已知:各有机物间存在如下转化关系
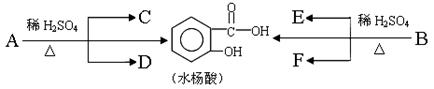 |
其中C能发生银镜反应,F经连续氧化可生成C;C与D是相对分子质量相同的不同类型的有机物。
(2)水杨酸中所含官能团的名称是____________;完全燃烧时,1 mol D与1 mol 下列有机物耗氧量相同的是____________(填字母代号)。
a. C3H6O3 b. C3H8O c. C2H4 d. C2H6O2
(3)B的结构简式是________________________;
水杨酸与小苏打溶液反应的化学方程式:_________________________________; 一定条件下,C与F反应的反应类型是____________。
(4)写出C与足量银氨溶液的反应化学方程式:________________________________;反应类型是____________。
(5)同时符合下列要求的化合物有____________种。
① 与A互为同分异构体 ② 可以水解
③ 苯环上有两个取代基,且苯环上的一氯代物只有1种
(6)1 mol上述(5)中的一种有机物X 在水溶液中,能与4 mol NaOH共热发生反应,写出此反应的化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在FeCl3和CuCl2的混合溶液中加入铁屑,反应结束后滤出固体物质,滤液中的阳离子可能是( )
①只有Fe2+ ②Fe2+和Fe3+
③Fe2+和Cu2+ ④Cu2+和Fe3+
A.①③ B.②④
C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。
工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。
工艺流程如图所示。
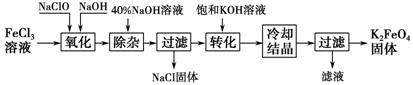
(1)完成“氧化”过程中反应的化学方程式:
FeCl3+____NaOH+____NaClO→____Na2FeO4+____+____。其中氧化剂是____(填化学式)。
(2)“转化”过程中发生反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是:将粗产品用________________溶解,然后________________。
方法Ⅱ:电解法。
以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH。
(4)电解时阳极发生反应生成FeO,该电极反应方程式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用如图所示的装置进行实验。
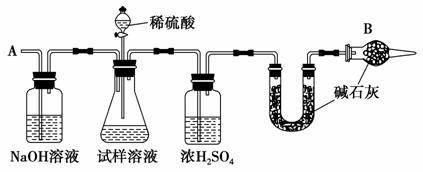
主要实验步骤如下:
①按照图示组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U形管的质量为b g
④从分液漏斗滴入6 mol·L-1的稀硫酸,直到不再产生气体为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U形管的质量为c g
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g
请回答下列问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明________________________________________________________________________。
(2)装置中干燥管B的作用是_____________________________________。
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测量的结果将________(填“偏高”、“偏低”或“不变”)。
(4)步骤⑤的目的是________________________________________。
(5)步骤⑦的目的是_______________________________________________。
(6)试样中纯碱的质量分数为________________(用含a、b、d的代数式表示)。
(7)还可以用其他实验方法测定试样中纯碱的质量分数,请简述一种不同的实验方法_______________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,把0.2 mol·L-1的醋酸加水稀释,则图中的纵轴y表示的是( )
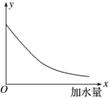
A.溶液中OH-的物质的量浓度
B.溶液的导电能力
C.溶液中的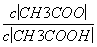
D.CH3COOH的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.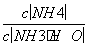 先增大再减小
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c(NH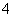 )=c(CH3COO-)
)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列实验事实得出的结论正确的是 ( )。
A.气体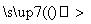 品红溶液褪色
品红溶液褪色
结论:原气体一定是SO2
B.气体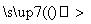 气体
气体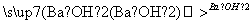 白色沉淀
白色沉淀
结论:原气体一定是烃
C.某溶液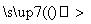 冒白雾
冒白雾 白烟
白烟
结论:原溶液一定是浓盐酸
D.某有色溶液 紫色
紫色
结论:原溶液中一定含有Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com