
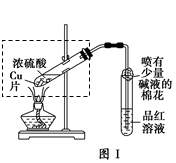
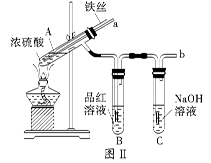
| 步骤 | 所选试剂 | 现象及结论 |
| 1 | | |
| 2 | | |
| 3 | | |
 CuSO4+2H2O+SO2↑(2分);
CuSO4+2H2O+SO2↑(2分); | 步骤 | 所选试剂 | 现象、结论 |
| 1 | KSCN溶液 | 若溶液变红,则含有Fe3+; 若不变红,则不含有Fe3+ |
| 2 | 稀H2SO4、KMnO4溶液 | 若KMnO4溶液褪色,则含有Fe2+;若不褪色,则不含有Fe2+ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.因浓硫酸具有强氧化性,故不可用它来干燥氢气 |
| B.浓硫酸与浓氨水靠近时产生大量白烟 |
| C.浓硫酸有强氧化性,稀硫酸不具有氧化性 |
| D.浓硫酸具有腐蚀性,取用时要小心 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
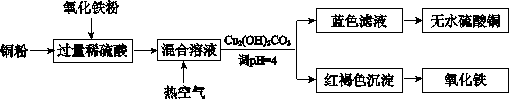
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 CaO+CO2 ㈡ 2CaO+2SO2+O2 =2CaSO4
CaO+CO2 ㈡ 2CaO+2SO2+O2 =2CaSO4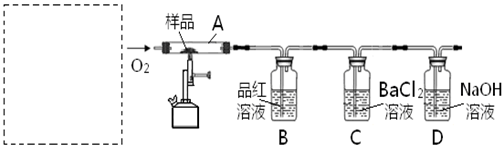
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
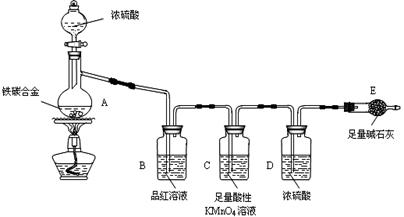
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com