
| A. | 若反应A(s)=B(s);△H<O,则说明A物质比B物质稳定 | |
| B. | Zn(s)+CuSO4 (aq)═ZnSO4 (aq)+Cu(s);△H=-216kJ•mol-1.则反应物总能量<生成物总能量 | |
| C. | 101kPa时,2H2(g)+O2(g)═2H2O(l);△H=-QkJ•mol-1,则H2的燃烧热为$\frac{1}{2}$QkJ•mol-l | |
| D. | H+(aq)+OH- (aq)=H2O(l);△H=-57.3 kJ•mol-1,含1mol NaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量 |
分析 A.物质具有的能量越低越稳定;
B.反应物的总能量大于生成物的总能量,为放热反应;
C.燃烧热是指完全燃烧1mol物质生成最稳定产物的过程放出的热量;
D.浓硫酸溶解过程放出大量的热量.
解答 解:A.A(s)=B(s)△H<O,说明A的能量大于B,能量越低越稳定,说明B物质比A物质稳定,故A错误;
B.Zn(s)+CuSO4 (aq)═ZnSO4 (aq)+Cu(s);△H=-216kJ•mol-1,则反应物总能量>生成物总能量,故B错误;
C.101kPa时,2H2(g)+O2(g)═2H2O(l);△H=-QkJ•mol-1,则101kPa时,H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-$\frac{1}{2}$QkJ•mol-1,则H2的燃烧热为$\frac{1}{2}$QkJ•mol-l,故C正确;
D.浓硫酸溶解时放热,0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ,故D错误;
故选C.
点评 本题考查了反应热、燃烧热、中和热的等知识,为高频考点,平时注意相关知识的理解和运用,题目难度不大.


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:解答题
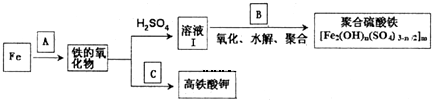
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②⑥ | C. | ④⑤⑦ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | E | F | G | |
| A | - | - | - | - | - | - | ↓ |
| B | - | - | - | - | ↓ | ↓ | ↓ |
| C | - | - | - | ↓ | ↓ | ↓ | |
| D | - | ↓ | - | ↓ | ↓ | ↓ | |
| E | - | ↓ | - | ↓ | - | ↓ | - |
| F | - | ↓ | ↓ | ↓ | ↓ | - | ↓ |
| G | ↓ | ↓ | ↓ | ↓ | - | ↓ | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S→SO3→H2SO4 | B. | Fe→FeCl3→FeCl2 | ||
| C. | Si→H2SiO3→Na2SiO3 | D. | Al2O3→Al(OH)3→NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
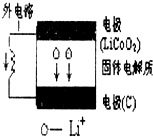
| A. | 电池内部“→”表示放电时Li+的迁移方向,外电路上的“→”表示放电时的电流方向 | |
| B. | 放电时负极的电极反应:LiCoO2-xe-═Li1-xCoO2+xLi+ | |
| C. | 充电时阴极的电极反应:6C+xLi++xe-═LixC6 | |
| D. | 当外电路有2 mole-通过,发生迁移的Li+的质量为7 g(Li的相对原子质量为 7) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 米酒变酸的过程涉及了氧化反应 | |
| B. | 汽油、柴油、植物油都是碳氢化合物 | |
| C. | 含5个碳原子的有机物分子中最多可形成4个碳碳单键 | |
| D. | 蛋白质的水解和油脂的皂化都是由高分子生成小分子的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将标准状况下的2.24L CO2通入150mL 1mol•L-1 NaOH溶液中,所得溶液中c(CO32-)>c(HCO3-) | |
| B. | 常温下0.1 mol•L-1的下列溶液①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ | |
| C. | 0.1 mol•L-1 pH为9的NaHB溶液中:c(HB-)>c(B2-)>c(H2B) | |
| D. | 室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合液pH=5,则c(A-)+c (OH-)>c (H+)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3) | |
| C. | Na2C2O4溶液与HCl溶液等体积混合(H2C2O4是二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+) | |
| D. | 0.1mol/LNH4Cl与0.1mol/L氨水溶液等体积混合:c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com