
 ����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCuO2�����ַ�����
����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCuO2�����ַ�����| ������ | ��̿���ڸ��������»�ԭCuO |
| ������ | ��ⷨ��2Cu+H2O$\frac{\underline{\;���\;}}{\;}$Cu2O+H2�� |
| ������ | ���£�N2H4����ԭ����Cu��OH��2 |
| ��� | �¶� | 0 | 10 | 20 | 30 | 40 | 50 |
| �� | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| �� | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| �� | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
���� ��1��̼����CuO��Ӧ�û���Cu��
��2����������������Ӧ������������Cu������ʧȥ���ӵõ�Cu2O��H2O��
��3������v=$\frac{��c}{��t}$����v��H2O��������������֮�ȵ����仯ѧ������֮�ȼ���v��O2����
��ʵ���¶�T1=T2��ʵ��۵�ЧΪ��ʵ��ٵĻ�����ѹǿ����һ����ƽ�������ƶ���ƽ��ʱˮ��ת���ʼ�С����ƽ��ʱ����ˮ��Ũ�ȴ��ڢ��е�2������ʵ�ʢ���ˮ��Ũ��С�ڢ��е�2����˵�����иı��¶�ƽ�������ƶ���
����Ч��Խ�ߣ���Ӧ����Խ�죬����ƽ��ʱ��Խ�̣�
��� �⣺��1��������Ӧ���������ƣ������²���̼��CuO�����û���Ӧ����Cu��ʹCu2O���ʽ��ͣ�
�ʴ�Ϊ��Cu��
��2����������������Ӧ������������Cu������ʧȥ���ӵõ�Cu2O��H2O�������缫��ӦʽΪ��2Cu-2e-+2OH-=Cu2O+H2O��
�ʴ�Ϊ��2Cu-2e-+2OH-=Cu2O+H2O��
��3��v��H2O��=$\frac{��0.050-0.0486��mol/L}{20min}$=7��10-5mol/��L��min��������֮�ȵ����仯ѧ������֮�ȣ���v��O2��=$\frac{1}{2}$v��H2O��=3.5��10-5mol/��L��min����
��ʵ���¶�T1=T2��ʵ��۵�ЧΪ��ʵ��ٵĻ�����ѹǿ����һ����ƽ�������ƶ���ƽ��ʱˮ��ת���ʼ�С����ƽ��ʱ����ˮ��Ũ�ȴ��ڢ��е�2������ʵ�ʢ���ˮ��Ũ��С�ڢ��е�2����˵�����иı��¶�ƽ�������ƶ�������ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ������¶�T1��T2��
ʵ��٢���ȣ�ʵ��ڵ���ƽ��ʱ��̣���Ӧ����Խ�죬����Ч�ʸߣ�
�ʴ�Ϊ��3.5��10-5mol/��L��min������������
���� ���������ʵ��Ʊ�Ϊ���壬����Ԫ�ػ��������ʡ����ԭ������Ӧ���ʼ��㡢��ѧƽ���뻯ѧ��Ӧ����Ӱ�����صȣ����ؿ���ѧ�������ݵķ��������������Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �÷�Ӧ���ؼ�С�ķ�Ӧ | |
| B�� | �÷�Ӧ�����ȷ�Ӧ����˲����Է����� | |
| C�� | �жϷ�Ӧ�ܷ��Է�������Ҫ���ݡ�H���S�ۺϿ��� | |
| D�� | ��NH4��2CO3��s����NH4HCO3��s���ȶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
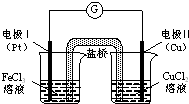
| A�� | �缫���Ϸ�����ԭ��Ӧ����ԭ��ص����� | |
| B�� | �缫��ĵ缫��ӦʽΪ��Cu-2e-�TCu2+ | |
| C�� | ��ԭ��ص��ܷ�ӦΪ��2Fe3++Cu�TCu2++2Fe2+ | |
| D�� | ������װ�к��Ȼ��ص���֬���������Ǵ��ݵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | һ�������£�5.2g��Ȳ�ͱ��Ļ�������к��е�̼ԭ����Ϊ0.4NA | |
| B�� | ��״���£�2.24L��������ԭ����Ϊ0.2NA | |
| C�� | 1mol�������ƹ����к�����������2 NA | |
| D�� | 5.6g Fe��������ˮ������ȫ��Ӧ��ת�Ƶ��ӵ���ĿΪ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
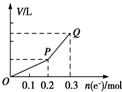 �ö��Ե缫�������ͭ��Һ����������ת�Ƶ��ӵ����ʵ������������������Ĺ�ϵ��ͼ��ʾ���������������ͬ״���²ⶨ������ʹ��Һ�ָ�����ʼ״̬��������Һ�м��루������
�ö��Ե缫�������ͭ��Һ����������ת�Ƶ��ӵ����ʵ������������������Ĺ�ϵ��ͼ��ʾ���������������ͬ״���²ⶨ������ʹ��Һ�ָ�����ʼ״̬��������Һ�м��루������| A�� | 0.1mol CuO | B�� | 0.1 mol CuCO3 | ||
| C�� | 0.1mol Cu��OH��2 | D�� | 0.05 mol Cu2��OH��2CO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
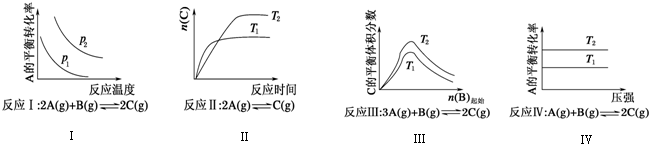
| A�� | ��Ӧ��H��0��p2��p1 | B�� | ��Ӧ��H��0��T2��T1���H��0��T2��T1 | ||
| C�� | ��Ӧ��H��0��T1��T2 | D�� | ��Ӧ������H��0��T2��T1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
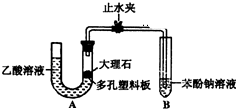 ijУѧ��С��Ϊ̽�����ᡢ̼��ͱ��ӵ�����ǿ����֤������Ϊ���ᣬ��������ʵ�飮̽�����ᡢ̼��ͱ��ӵ�����ǿ����ϵ��Уѧ���������ͼ��ʵ��װ�ã��г���������ȥ����
ijУѧ��С��Ϊ̽�����ᡢ̼��ͱ��ӵ�����ǿ����֤������Ϊ���ᣬ��������ʵ�飮̽�����ᡢ̼��ͱ��ӵ�����ǿ����ϵ��Уѧ���������ͼ��ʵ��װ�ã��г���������ȥ���� -ONa��Һ��pH����pH�ɴ�С���е�˳��Ϊbdac��������Һ��ţ�
-ONa��Һ��pH����pH�ɴ�С���е�˳��Ϊbdac��������Һ��ţ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com