
【题目】科学家认为,氢气是21世纪一种高效而无污染的理想能源。
(1)为了有效发展氢能源,首先必须制得廉价的氢气,下列可供开发较经济且资源可持续利用的制氢气的方法是___。
A.电解水 B.锌和稀硫酸反应 C.催化光解海水 D.分解天然气
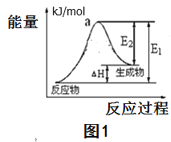
(2)用水分解获得氢气的能量变化如图1所示,则此反应的焓变△H=___kJ/mol。(请用关于E1,E2的代数式表示)。
(3)以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+206.2kJmol﹣1
CH4(g)+CO2(g)═2CO(g)+2H2(g) △H=+247.4kJmol﹣1
则CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=___kJmol﹣1
(4)某固体酸膜氢氧燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构如图2所示,请按要求回答下列问题:
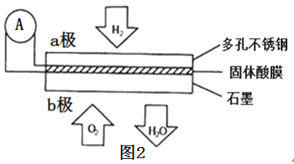
①b极上的电极反应式为___。
②此电池工作时每消耗4.48L(标准状况下)H2,转移电子___mol。
③若将这些电子用于铅蓄电池(两极板上分别覆盖有Pb、PbO2,电解质溶液是H2SO4溶液)充电,铅蓄电池中产生H2SO4的物质的量为___mol,铅蓄电池阳极发生的反应为___。
【答案】C (E1-E2) 165 O2+4H++4e-=2H2O 0.4 0.4 PbSO4+2H2O-2e-=PbO2+SO42-+4H+
【解析】
(1)开发较经济且资源可持续利用的制氢气方法要从能源消耗分析;
(2)催化剂能降低反应活化能;
(3)利用盖斯定律解答,从待求反应出发分析反应物、生成物在所给反应
(4)根据原电池工作原理进行分析解答;
(1)A.电解水需要大量的电能,不符合廉价的要求,故A错误;
B.锌和稀硫酸反应,消耗大量的锌和硫酸,不符合廉价的要求,故B错误;
C.光解海水,可充分利用光能,廉价而又低碳,符合要求,故C正确;
D.天然气不是可持续能源,故D错误;
故答案:C;
(2)根据用水分解获得氢气的能量变化如图可知,反应物的活化能为E1,生成物的活化能为E2,则此反应的焓变△H= (E1-E2) kJ/mol,故答案:(E1-E2);
(3)由已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJmol﹣1,②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.4kJmol﹣1,根据盖斯定律:①![]() 2-②:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+206.2kJmol﹣1
2-②:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+206.2kJmol﹣1![]() 2-247.4kJmol﹣1=+165kJmol﹣1,故答案:+165;
2-247.4kJmol﹣1=+165kJmol﹣1,故答案:+165;
(4)①通入氧气的一极为电池的正极发生还原反应,电极反应式为O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O;
②n(H2)=![]() =0.2mol,根据负极反应式H2-2e-=2H+可知,转移电子为0.2mol
=0.2mol,根据负极反应式H2-2e-=2H+可知,转移电子为0.2mol![]() 2=0.4mol,故答案:0.4;
2=0.4mol,故答案:0.4;
③给铅蓄电池充电时发生2PbSO4+2H2O=Pb+PbO2+2H2SO4,每生成2个H2SO4,转移电子数为2个,当转移0.4mol电子时,铅蓄电池中产生H2SO4的物质的量为0.4mol;阳极是PbSO4失去电子生成PbO2、SO42-、H+,发生氧化反应,阳极电极反应式为PbSO4+2H2O-2e-=PbO2+SO42-+4H+,故答案为: 0.4 ;PbSO4+2H2O-2e-=PbO2+SO42-+4H+。


科目:高中化学 来源: 题型:
【题目】完成下列填空。
(1)在 25℃、101kPa 时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为 393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则 2C(s)+2H2(g)+O2(g)= CH3COOH(l)的△H=___________。
(2)温度为 T 时,在 2 L 的密闭容器中加入 2.0 mol SO2 和 1.0 mol O2 发生反应,达到平衡时容器内气体压强变为起始时的 0.7 倍。该反应的平衡常数为_____。
(3)在一定体积 pH=12 的 Ba(OH)2 溶液中,逐滴加入一定物质的量浓度的 NaHSO4 溶液, 当溶液中的 Ba2+恰好完全沉淀时,溶液 pH=11。若反应后溶液的体积等于 Ba(OH)2 溶液与 NaHSO4 溶液的体积之和,则 Ba(OH)2 溶液与 NaHSO4 溶液____
(4)利用如图所示的电解装置,可将雾霾中的 NO、SO2 转化为硫酸铵,从而实现废气的回 收再利用。通入 NO 的电极反应式为_____;若通入的 NO 体积为 4.48 L(标况下),则理论上另一电极通入 SO2 的物质的量应为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的有
①3lg白磷中含有1.5NA个P-P键
②1L0.1mol·L-1的Na2CO3溶液中所含阴离子的总数目为0.1NA
③标准状况下,22.4LHF 中含有NA个分子
④电解精炼铜时,若转移NA个电子,则阳极溶解32g铜
⑤将2.24L(标准状况)Cl2溶于水,转移的电子数为0.1NA
⑥常温下,含有0.2molH2SO4的浓硫酸与足量铜反应,生成SO2分子的数目小于0.1NA
⑦142gNa2SO4 和Na2HPO4的固体混合物中所含阴、阳离子的总数目为3NA
⑧NA个Fe(OH)3胶体粒子的质量为107g
A.2项B.3项C.4项D.5项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家利用电解NaB(OH)4溶液制备H3BO3的工作原理如下图。 下列说法中正确的是
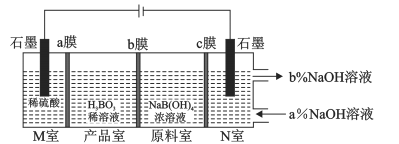
A.b膜为阳离子交换膜
B.N室中,进口和出口NaOH溶液的浓度:a%<b%
C.电子从左边石墨电极流出,先后经过a、b、c膜流向右边石墨电极
D.理论上每生成1molH3BO3,两极室共生成33.6L气体(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )

A.该反应的化学方程式为3B+2D![]() 6A+4C
6A+4C
B.反应进行到1s时,v(A)=3v(D)
C.反应进行到6s时,各物质的反应速率相等
D.反应进行到6s时,B的平均反应速率为0.05mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的核磁共振氢谱如图M1-1所示,下列说法中,错误的是
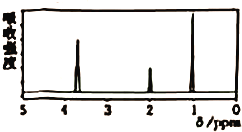
A. 若A的分子式为![]() ,则其结构简式为
,则其结构简式为![]()
B. 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子,且个数之比为1:2:3
C. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D. 若A的化学式为![]() ,则其同分异构体有3种
,则其同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚维酮碘的水溶液是一种常用的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如图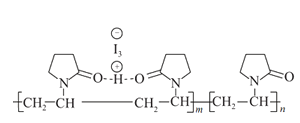 ,下列说法不正确的是( )
,下列说法不正确的是( )
A.聚维酮的单体是![]() B.聚维酮分子由(m+n)个单体聚合而成
B.聚维酮分子由(m+n)个单体聚合而成
C.聚维酮碘是一种水溶性物质D.聚维酮在一定条件下能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰气的化学式为![]() ,结构式为
,结构式为![]() ,性质与卤素相似,下列有关叙述正确的是( )
,性质与卤素相似,下列有关叙述正确的是( )
A.氰气分子中既有极性键,又有非极性键
B.氰气分子中![]() 键的键长大于
键的键长大于![]() 键的键长
键的键长
C.氰气分子中含有2个![]() 键和4个
键和4个![]() 键
键
D.氰气不能和氢氧化钠溶液发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com