
【题目】脲醛树脂的合成与酚醛树脂类似,生成线型脲甲醛树脂的方程式为:n![]() +nHCHO
+nHCHO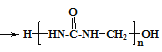 +xH2O,下列说法不正确的是( )
+xH2O,下列说法不正确的是( )
A.网状的脲甲醛树脂以如图所示结构单元为主
B.方程式中的化学计量数x=n-1
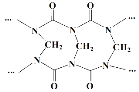
C.脲甲醛树脂合成过程中可能存在中间体![]()
D.通过质谱法测定线型脲甲醛树脂的平均相对分子质量,可得其聚合度
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的结构简式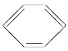 看,苯分子中含有碳碳双键,应属于烯烃
看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的化学键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期元素组成的中学常见的含钠元素的物质A、B、C、D,存在如图转化关系(部分生成物和反应条件已略去)。
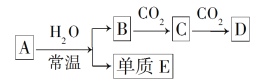
(1)若A为金属钠,A与水反应的离子方程式为_______________。
(2)若A为淡黄色的固体化合物,A________(填“是”或“不是”)碱性氧化物,A与CO2反应的化学方程式为_________________。
(3)A不论是Na还是淡黄色的固体化合物,依据转化关系判断物质C是________,物质D是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙两个恒容密闭容器中分别充入一定量的SiHCl3,发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g) ΔH=+48kJ·mol1,维持容器的温度分别为T1℃和T2℃不变,反应过程中SiHCl3的转化率随时间的变化如图所示。下列说法正确的是( )
SiH2Cl2(g)+SiCl4(g) ΔH=+48kJ·mol1,维持容器的温度分别为T1℃和T2℃不变,反应过程中SiHCl3的转化率随时间的变化如图所示。下列说法正确的是( )
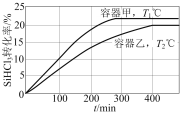
A.T1>T2
B.维持温度不变,向平衡后的乙容器中充入一定量的SiHCl3,平衡不移动
C.T2℃时,反应的平衡常数:K=![]()
D.T1℃时,向甲容器中起始充入0.2molSiHCl3和0.02molSiH2Cl2,SiHCl3的平衡转化率小于10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯乙酸(CCl3COOH)是饮用水中常见污染物,难以直接氧化降解。通过Fe/Cu微电池法和芬顿法可将三氯乙酸除去。
(1)pH=4时,向含有三氯乙酸的水样中投入铁屑和铜屑,通过原电池反应生成的活性氢原子(H)将CCl3COOH脱氯后转化为CHCl2COOH。
①原电池反应时的负极反应式为___。
②写出活性氢原子(H)与CCl3COOH反应的离子方程式:___。
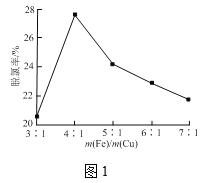
③铁屑和铜屑的总质量一定,改变铁屑和铜屑的质量比,水样中单位时间三氯乙酸的脱氯率如图1所示,当m(Fe)/m(Cu)大于4时,铁屑质量越大,脱氯率越低的原因是___。
(2)取上述反应后的溶液,向其中加入H2O2,发生图2所示转化,生成羟基自由基(·OH),·OH能将溶液中的CHCl2COOH等物质进一步脱氯除去。
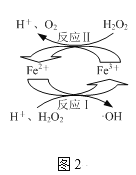
①图2所示转化中化合价未发生变化的元素是___。
②写出图2所示转化中反应Ⅱ的离子方程式:___。
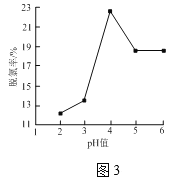
③控制水样的pH不同,所得脱氯率如图3所示,当pH>4后,脱氯率逐渐下降的原因是___。
④加入H2O2后需控制溶液的温度,温度过高时脱氯率减小的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印刷电路板(PCB)是用腐蚀液将覆铜板上的部分铜腐蚀掉而制得。一种用FeCl3溶液制作PCB并将腐蚀后废液回收再生的流程如图:
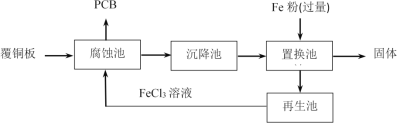
下列说法不正确的是( )
A.腐蚀池中发生反应的化学方程式是:Cu+2FeCl3=CuCl2+2FeCl2
B.腐蚀后的废液中,主要的金属阳离子有Fe3+、Cu2+、Fe2+
C.置换池中发生的主要反应为:Fe+Cu2+=Cu+Fe2+和Fe+2Fe3+=3Fe2+
D.再生池中加入酸化的H2O2,反应过程中pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大, X、Z、W 均可形成酸性氧化物。X的一种氢化物分子空间构型为三角锥型,YW是氯碱工业的主要原料,Z的最外层电子数为4,请回答以下问题:
(1)表示氯碱工业生产原理的化学方程式为____________________________________。
(2)X的另一种氢化物X2H4可作为火箭推进器燃料,其结构式为__________________ 。
(3)Y的氧化物中,有一种既含离子键又含共价键,该氧化物的电子式为 ___________。
(4)Z的氧化物属于晶体,工业制备Z单质的化学方程式为________________________。
(5)W单质是毒性很大的窒息性气体。工业上用X气态氢化物的浓溶液检验W单质是否泄露,写出反应的化学方程式_________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的化学资源宝库,利用海水可以获取很多物质。海水中主要离子有Na+、K+、Ca2+、Mg2+、Cl-、SO42-等。
利用1:淡水工业
(1)海水淡化的方法主要有__、电渗析法、离子交换法等。
(2)电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示。
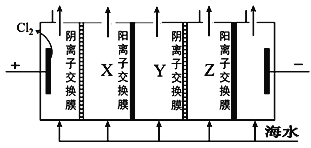
①淡水在__室(填X、Y或Z)形成后流出。
②一般海水不直接通入到阴极室中,原因是______________。
(3)离子交换法净化海水模拟过程如图所示,氢型阳离子交换原理可表示为:HR+Na+=NaR+H+,……。羟型阴离子交换树脂填充段存在的反应有______________。
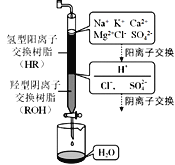
利用2:提溴工业
(4)用海水晒盐之后的盐卤可提取溴,提取流程如图:

①用热空气将溴赶出,在吸收塔先用浓Na2CO3溶液吸收Br2,Br2歧化为Br-和BrO3-,再加入W溶液得到Br2。推测W是______________。
②蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是____________。
③将1m3海水浓缩至1L,使用该法最终得到38.4gBr2,若总提取率为60%,则原海水中溴的浓度是__mg/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这个碳原子被称为“手性碳原子”,凡含有手性碳原子的物质一定具有光学活性,如物质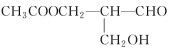 有光学活性,发生下列反应后生成的有机物无光学活性的是( )
有光学活性,发生下列反应后生成的有机物无光学活性的是( )
①与甲酸发生酯化反应 ②与NaOH溶液反应 ③与银氨溶液作用 ④在催化剂存在下与氢气作用
A. ①③B. ②④
C. ①④D. ②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com