
[实验化学]
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
|
物质 |
沸点/℃ |
熔点/℃ |
密度(20℃) / g·cm-3 |
溶解性 |
|
甲醇 |
64. 7 |
|
0. 7915 |
易溶于水 |
|
乙醚 |
34. 5 |
|
0. 7138 |
微溶于水 |
|
3,5-二甲氧基苯酚 |
|
33 ~36 |
|
易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的 。
②萃取用到的分液漏斗使用前需 并洗净,分液时有机层在分液漏斗的 填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是 ;用饱和食盐水洗涤的目的是 。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是 (填字母)。
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先 ,再 。
(1)①蒸馏 ②检查是否漏水 上
(2)除去HCl 除去少量NaHCO3且减少产物损失
(3)dcab
(4)拆去连接抽气泵和吸滤瓶的橡皮管 关闭抽气泵
【解析】间苯三酚和氯化氢的甲醇溶液反应后,生成3,5-二甲氧基苯酚,同时产品中还含有过量的甲醇,HCl和水,然后除去其中的这些杂质即可。
(1)根据表中给出的物理性质数据,除去甲醇可采用蒸馏,之后利用3,5-二甲氧基苯酚易溶于乙醚、微溶于水的性质,加入乙醚进行萃取,静置后分层,乙醚的密度比水小,因而有机层在上层。
(2)分离后的有机层,除了产品3,5-二甲氧基苯酚,还有乙醚,HCl,水。利用这些物质的物理化学性质差异,先加入饱和的NaHCO3溶液洗涤,除去HCl,再加入饱和食盐水除去过量的NaHCO3,同时又减少了产物3,5-二甲氧基苯酚的溶解度,减少溶解的损失。
(3)洗涤后的产品中还有乙醚和水两种杂质。操作是先除水再除乙醚。除水先加入加入无水CaCl2干燥,然后过滤,除去干燥剂,之后蒸馏除去乙醚,再采用重结晶的方法得到纯度较高的产品。正确的顺序是:dcab。
(4)减压过滤时,当漏斗颈下再无液滴滴下时,可判断已抽吸干燥,此时过滤完全,先拔掉连接抽气泵和吸滤瓶的橡皮管,后关抽气泵,以免循环水真空抽气泵中的水倒吸污染滤液。本问要理解减压过滤的原理。
【考点定位】本题考查物质的制备实验。实验包括制备,分离和提纯。要求学生根据题给的信息,对目标物质进行制备,以及掌握常见的物质的分离和提纯的方法及其注意事项。


科目:高中化学 来源: 题型:阅读理解
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 用图示装置制取少量乙酸乙酯(酒精灯、铁架台等在图中均已略去),请填空:
用图示装置制取少量乙酸乙酯(酒精灯、铁架台等在图中均已略去),请填空:| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验编号 | T/℃ | 颗粒大小/μm | 干燥方式 | 实验目的 |
| 1 | 60 | 40 | 烘箱干燥 | (Ⅰ)实验1和2制得的镍催化剂,用于探究制备的干燥方式对镍催化剂损耗的影响 (Ⅱ)实验1和3制得的镍催化剂,用于探究制备的制备温度对镍催化剂损耗的影响 (Ⅲ) |
| 2 | ||||
| 3 | ||||
| 4 | 60 | 55 | 烘箱干燥 |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
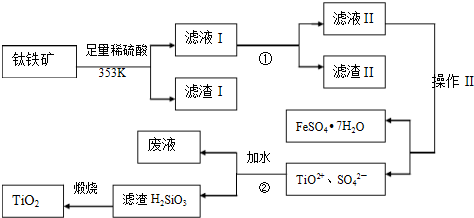
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com