
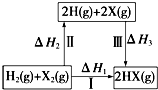
| A. | H2(g)+X2(g)═2H(g)+2X(g)△H2<0 | |
| B. | △H1=△H2+△H3 | |
| C. | 途径Ⅲ的按Cl、Br、I顺序依次增大 | |
| D. | 途径Ⅰ生成HCl比生成HBr的△H1小,说明HCl比HBr稳定 |
分析 A、化学键的断裂要吸热,焓变大于0;
B、依据盖斯定律分析,反应焓变与起始物质和终了物质有关于变化途径无关;
C、HCl、HBr、HI的化学键的键能逐渐减小;
D、根据化学反应所吸收或放出的能量即为反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差来判断.
解答 解:A、化学键的断裂要吸热,焓变大于0,H2(g)+X2(g)═2H(g)+2X(g)△H2>0,故A错误;
B、反应焓变与起始物质和终了物质有关于变化途径无关,途径Ⅰ生成HX的反应热与途径无关,所以△H1=△H2+△H3 ,故B正确;
C、途径III是断形成化学键的过程,是放热过程,Cl、Br、I的原子半径依次增大,故形成HCl、HBr、HI化学键所放出的能量逐渐减小,故C错误;
D、因化学反应所吸收或放出的能量即为反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差,氯原子半径小于溴原子,途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定,故D正确;
故选BD.
点评 本题考查了合成反应能量变化,反应焓变分析判断,物质结构和同主族性质变化规律是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
| 0 | 2.0 | 2.0 | 0 |
| 2 | 0.8 | ||
| 4 | 1.2 | ||
| 6 | 1.2 | 2.8 |
| A. | 0~2 min内的平均速率为υ(CO)=0.6mol/(L•min) | |
| B. | 4min后,平衡移动的原因可能是向容器中加入了2.0mol的SO2 | |
| C. | 若升高温度,反应的平衡常数变为1.0,则正反应为放热反应 | |
| D. | 其他条件不变,若起始时容器中MgSO4、CO均为1.0mol,则平衡时n(SO2)=0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②⑤⑥ | C. | ②③⑤⑥ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
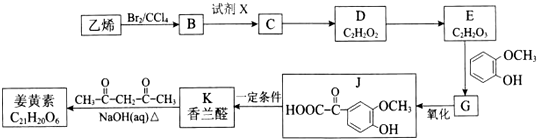
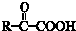 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$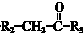
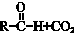 $→_{△}^{NaOH(ap)}$R1-
$→_{△}^{NaOH(ap)}$R1-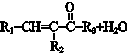
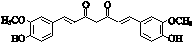 .
.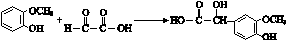 ;其反应类型是加成反应.
;其反应类型是加成反应.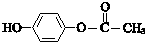 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com