
【题目】甲醛(HCHO)是一种重要的化工产品,工业上可用甲醇脱氢法制备,相关反应方程式为:CH3OH(g) ![]() HCHO(g)+H2(g) △H=+akJ/mol回答下列问题:
HCHO(g)+H2(g) △H=+akJ/mol回答下列问题:
(1)反应过程中需要向体系中通入空气,通过以下反应提供上述反应所需要的热量:H2(g)+![]() O2(g)=H2O(g) △H=-bkJ/mol
O2(g)=H2O(g) △H=-bkJ/mol
要使反应温度维持在650℃,则进料时,甲醇和空气的体积比应为___(已知空气中氧气的体积分数为20%,b>a)。
(2)Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程i:CH30H→H+CH2OH(H叫做氢自由基,实际上就是H原子,有很高的反应活性,
“”代表有一个单电子可以参与配对成键)
历程ii:CH2OH→H+HCHO
历程iii:CH2OH→3H+CO
历程iv:自由基发生碰撞形成新化学键而湮灭
如图1所示为在体积为2L的恒容容器中,投入1molCH3OH(g),在碳酸钠催化剂作用下开始反应,20min后,测得甲醇的转化率(X)与甲醛的选择性(S)与温度的关系(副反应仅考虑CH3OH![]() CO+2H2):
CO+2H2):
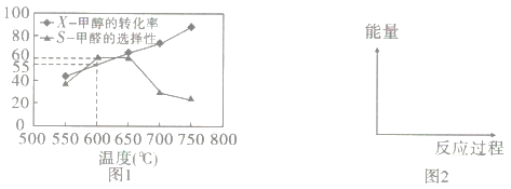
①请在图2所给坐标中,画出历程iv的反应过程一能量变化示意图___。
②下列说法合理的是__。
a.升高温度,甲醇转化率提高,平衡常数变大
b.当体系气体密度保持不变时,达到平衡状态
c.及时分离产品有利于提高甲醇生成甲醛的转化率
③600℃时,前20min甲醇的平均反应速率为__,此时生成甲醛的反应的Qp=___(Qp的表达式与平衡常数Kp相同,p为物质的分压,分压=总压×物质的量分数,体系初始压强为P0)
④650℃以后,甲醛的选择性降低,而甲醇的转化率升高的可能原因是___。
(3)氧化剂可处理甲醛污染,结合以下图像分析夏季(水温约20℃)应急处理甲醛污染的水源最好应选择的试剂为____。

【答案】![]()
 ac 0.01375mol/(L·min) 0.56P0 温度升高,平衡正向移动,甲醇转化率升高,但由于温度高于650℃后,催化甲醛生成的催化剂催化能力降低,因此甲醛选择性下降 Ca(ClO)2
ac 0.01375mol/(L·min) 0.56P0 温度升高,平衡正向移动,甲醇转化率升高,但由于温度高于650℃后,催化甲醛生成的催化剂催化能力降低,因此甲醛选择性下降 Ca(ClO)2
【解析】
此题利用工业上制备甲醛方法综合考查化学反应原理,考点涉及热量,化学平衡移动,催化反应历程,考查图像解读能力和计算能力。
(1)要使反应温度维持在650℃,应保证放热反应放出的热量恰好被吸热反应全部利用,则甲醇与氧气的物质的量之比为![]() ,相同条件下,物质的量之比等于体积比,故甲醇与氧气的体积之比为
,相同条件下,物质的量之比等于体积比,故甲醇与氧气的体积之比为![]() ,空气中氧气的体积分数为20%,则甲醇与空气的体积之比为
,空气中氧气的体积分数为20%,则甲醇与空气的体积之比为![]() ;
;
(2)①历程iv:自由基发生碰撞形成新化学键而湮灭,自由基具有很高的能量,在形成新化学键时能量降低,且随着不断形成新化学键,自由基浓度减小,能量减低速率减慢,故能量变化示意图为 ;
;
②a.根据图Ⅰ可知,随着温度的升高,甲醇的转化率也在逐渐升高,说明反应往正向进行的程度在增大,K增大,a正确;
b.气体密度= ![]() ,在恒容容器中,总体积保持不变,气体总质量守恒,故气体密度始终不变,不能作为平衡判据,b错误;
,在恒容容器中,总体积保持不变,气体总质量守恒,故气体密度始终不变,不能作为平衡判据,b错误;
c.及时分离产品,平衡将向正向移动,有利于提高甲醇生成甲醛的转化率,c正确;
故合理的为ac;
③600℃、20min时甲醇的转化率为55%,则Δn=0.55mol,平均反应速率v=![]() =
=![]() =0.01375 mol/(L·min),此时甲醛的选择性为60%,则主反应CH3OH(g)
=0.01375 mol/(L·min),此时甲醛的选择性为60%,则主反应CH3OH(g)![]() HCHO(g)+H2(g),得到n1(H2)=n(HCHO)=0.55mol×60%=0.33mol,副反应CH3OH
HCHO(g)+H2(g),得到n1(H2)=n(HCHO)=0.55mol×60%=0.33mol,副反应CH3OH![]() CO+2H2,得到n2(H2)=2n(CO)=2×0.55mol×(1-60%)=0.44mol,n(H2)= n1(H2)+ n2(H2)=0.77mol,在温度一定体积一定的条件下,压强之比等于物质的量之比,甲醛Qp=
CO+2H2,得到n2(H2)=2n(CO)=2×0.55mol×(1-60%)=0.44mol,n(H2)= n1(H2)+ n2(H2)=0.77mol,在温度一定体积一定的条件下,压强之比等于物质的量之比,甲醛Qp= ![]() ==
==![]() = 0.56P0;
= 0.56P0;
④温度升高,平衡正向移动,甲醇转化率升高,但由于温度高于650℃后,催化甲醛生成的催化剂能力降低,因此甲醛选择性下降;
(3)由图像可知,夏季(水温约20℃)时甲醛去除率最高的是Ca(ClO)2,故最好应选择的试剂为Ca(ClO)2。


科目:高中化学 来源: 题型:
【题目】执法交警最常用的一种酒精检测仪的工作原理示意图如图所示,其反应原理为CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是( )

A.呼出气体中酒精含量越高,微处理器中通过的电流越小
B.电解质溶液中的H+移向a电极
C.b为正极,电极反应式为O2+2H2O+4e-=4OH-
D.a极上的电极反应式为CH3CH2OH+H2O-4e-=CH3COOH+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铋在工业上常用于制造低熔点合金,用于消防装置、自动喷水器、锅炉等的安全塞,一旦发生火灾,一些水管的活塞会“自动”熔化,喷出水来。由一种铋矿(主要成分为Bi2S3,含强氧化性杂质PbO2等)制备金属铋的简单工艺如图:
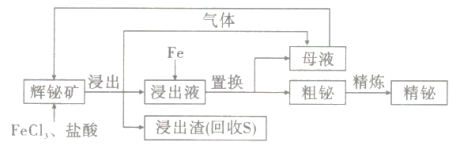
已知:酸性溶液中,氧化性PbO2>KMnO4
回答下列问题:
(1)“浸出”时发生的离子反应包括___、___。
(2)浸出液必须保持强酸性,否则铋元素会以BiOCl(碱式氯化铋)形式混入浸出渣使产率降低,原因是___。
(3)检验母液中主要金属阳离子的方法是___。
(4)乙二胺四乙酸二钠盐(EDTA)可以和Bi3+1:1形成稳定的配合物,一种测定浸出液中Bi3+浓度的方法如下:取25mL浸出液,调节pH=l,滴入2滴二甲酚橙作指示剂(二甲酚橙:溶于水呈亮黄色,能和多种金属阳离子形成紫红色配合物),用0.01000mol/L的EDTA溶液滴定,达到滴定终点时,测得耗去标准液35.00mL,则浸出液中Bi3+的浓度为___g/L,达到滴定终点的现象是__。
(5)以Bi2(SiF6)3的水溶液为电解液,可以实现粗铋的电解精炼。电解过程中,当电路中通过0.3mol电子时,阴极析出的金属Bi的质量为__;电解一段时间后,电解液会有损失,并会出现大量杂质,加入___(填化学式)可以除去该杂质,并使电解液H2SiF6再生。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
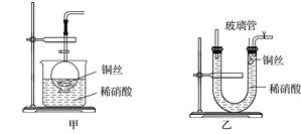
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
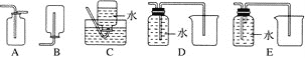
(4)以下收集NO气体的装置,合理的是________(填序号)。
(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应mA(s)+nB(g)![]() eC(g)+fD(g),当其他条件不变时,C的体积分数[φ(C)]在不同温度(T)和不同压强(p)下随时间(t)的变化关系如图所示。下列叙述正确的是( )
eC(g)+fD(g),当其他条件不变时,C的体积分数[φ(C)]在不同温度(T)和不同压强(p)下随时间(t)的变化关系如图所示。下列叙述正确的是( )
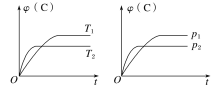
A.达到平衡后,若使用催化剂,C的体积分数将增大
B.该反应的ΔH<0
C.化学方程式中,n>e+f
D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.
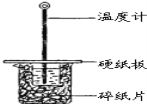
(1)下列说法不正确的是( )
A.该实验也可在保温杯中进行
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是保温、隔热,减少热量损失
D.若将盐酸体积改为60mL,两次实验所求得中和热不相等
(2)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是_________
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.量取NaOH溶液的体积时仰视读数
D.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
(3)将一定量的稀氨水、稀氢氧化钠溶液、稀氢氧化钡溶液分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________;
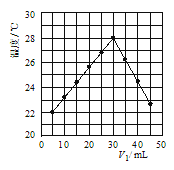
(4)若将V1mL1.0molL-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).由图2可知,氢氧化钠的浓度为 __________ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种重要的化工原料,部分性质及转化关系如图:
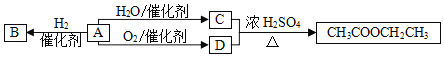
请回答:
(1)D中官能团的名称是_____。
(2)A→B的反应类型是_____。
A.取代反应B.加成反应C.氧化反应
(3)写出A→C反应的化学方程式_____。
(4)下列说法不正确的是_____。
A.B物质不能使溴水和酸性高锰酸钾褪色
B.A在一定条件下可与氯化氢发生加成反应
C.有机物C、D可用金属钠鉴别
D.A分子所有原子在同一个平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物。
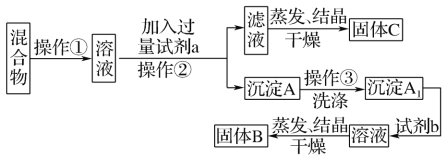
供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸。试回答下列问题:
(1)操作①的名称是____,操作②的名称是____。
(2)试剂a是_____(填化学式,下同),试剂b是____,固体B是____。
(3)加入试剂a所发生反应的化学方程式为_____。加入试剂b所发生反应的离子方程式为_____。
(4)该方案能否达到实验目的:_____(填“能”或“不能”)。若不能,应如何改进?_____(若能,此问不用回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是( )
3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5mol·L-1·s-1B.v(B)=0.3mol·L-1·s-1
C.v(C)=0.3mol·L-1·s-1D.v(D)=1mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com