
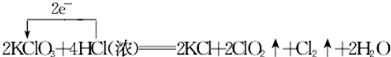 .
.分析 (1)重铬酸铵[(NH4)2Cr2O7]是一种受热易分解的盐,分解时发生氧化还原反应,N元素的化合价应升高,Cr元素的化合价应降低,以此来解答;
(2)n(KI)=0.06mol,与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则n(I2)=n(KIO3)=0.02mol,由此书写反应方程式;
(3)a.KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,据此分析;
B.反应中KClO3为氧化剂,HCl为还原剂;
c.根据HCl中氯元素化合价由-1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各中一半;
d.反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,据此计算转移电子物质的量;
解答 解:(1)重铬酸铵[(NH4)2Cr2O7]是一种受热易分解的盐,分解时发生氧化还原反应,N元素的化合价应升高,Cr元素的化合价应降低,
即N元素由-3价可能升高为0价,
Cr元素的化合价由+6价降低为+3价,
只有D符合,故选:D;
(2)n(KI)=0.06mol,与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则n(I2)=n(KIO3)=0.02mol,所以方程式为:15I-+8MnO4-+34H+=5I2+5IO3-+8Mn2++17H2O,故答案为:15I-+8MnO4-+34H+=5I2+5IO3-+8Mn2++17H2O;
(3)a.KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,则电子转移的方向和数目为: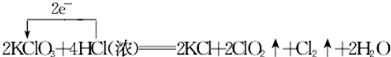
故答案为: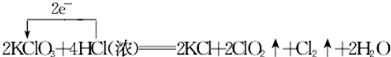 ;
;
B.KClO3氯元素的化合价降低,是氧化剂,HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高,氯元素被氧化,则氧化剂与还原剂的物质的量之比为1:1,
故答案为:1:1;
c.反应2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O中,HCl中氯元素化合价由-1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各中一半,
故选:②;
d.反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,所以产生0.1molCl2,转移的电子的物质的量为0.1mol×2=0.2mol,
故答案为:0.2mol.
点评 本题以氯气的制法来考查酸的性质,氧化还原反应中转移的电子数的计算,明确化合价的变化是分析的关键,题目难度中等.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
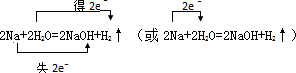 .反应中若产生0.2mol的气体,则有0.4mol的电子转移.
.反应中若产生0.2mol的气体,则有0.4mol的电子转移.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
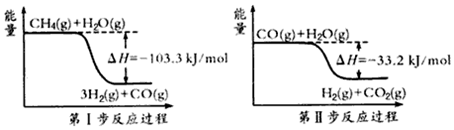
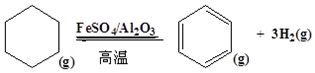
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com