
| A. | 14.3g | B. | 25.4g | C. | 28.6g | D. | 50.6g |
分析 发生反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,可得关系式:4HCl(被氧化)~2Cl2~CaCl2+Ca(ClO)2,据此计算.
解答 解:由MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
可得以下关系:4HCl(被氧化)~2Cl2~CaCl2+Ca(ClO)2,
设生成漂白粉的质量为m,则:
4HCl(被氧化)~2Cl2~CaCl2+Ca(ClO)2
4×36.5g 254g
14.6g m(漂白粉)
所以m(漂白粉)=$\frac{14.6×254}{4×36.5}$=25.4g,
故选:B.
点评 本题考查氯气的实验室制法及氯气和消石灰反应的有关计算,注意对方程式质量关系的理解与关系式的应用,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 燃放烟花产生的焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 废旧电池应集中回收,并填埋处理 | |
| C. | 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 | |
| D. | 加热能杀死H7N9禽流感病毒是因为病毒的蛋白质受热变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
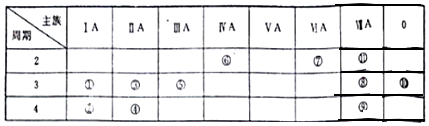
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与CO2反应生成Na2CO3:Na2O2+CO2═Na2CO3+O2 | |
| B. | Na2CO3溶液呈碱性:CO32-+H2O?H2CO3+OH- | |
| C. | Na2CO3溶液除去CH3COOC2H5中的CH3COOH:CO32-+2H+═CO2↑+H2O | |
| D. | 饱和Na2CO3溶液处理水垢中的CaSO4:CO32-+CaSO4═CaCO3+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
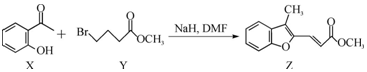
| A. | 物质X中所有碳原子可能在同一平面内 | |
| B. | 可用FeCl3溶液鉴别Z中是否含有X | |
| C. | 等物质的量的X、Z 分别与H2加成,最多消耗H2的物质的量之比为3:5 | |
| D. | 等物质的量的X、Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时俯视刻度线,会使所配溶液浓度偏大 | |
| B. | 将4.0gNaOH固体溶于1L水中可配成0.1mol/L的NaOH溶液 | |
| C. | 固体溶解后,将溶液转移到容量瓶中,然后向容量瓶中直接加水到刻度线 | |
| D. | 称量时,将固体NaOH放在垫有纸的托盘天平左盘上 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | V(H2SO4)/mL | c(H2SO4)/mol•L-1 | t/s |
| I | 40 | 1 | t1 |
| II | 40 | 3 | t2 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com