
| A. | 苯的同系物都能使酸性高锰酸钾溶液褪色 | |
| B. | 红外光谱、核磁共振氢谱都可以鉴别乙醇和甲醚 | |
| C. | 符合相同通式的不同物质一定是同系物 | |
| D. | 某有机物燃烧后只生成二氧化碳和水,则一定不含有氧元素 |
分析 A.如与苯环直接相连的碳原子不含氢原子,则难以被高锰酸钾氧化;
B.乙醇和甲醚含有共价键、氢原子种类不同;
C.同系物应具有相同的结构;
D.烃以及含氧衍生物,燃烧可生成二氧化碳和水.
解答 解:A.与苯环直接相连的碳原子含氢原子,可被高锰酸钾氧化,否则难以被高锰酸钾氧化,故A错误;
B.乙醇和甲醚含有共价键、氢原子种类不同,可用红外光谱、核磁共振氢谱鉴别,故B正确;
C.符合相同通式的不同物质,如结构不同,则不是同系物,故C错误;
D.烃以及含氧衍生物,燃烧可生成二氧化碳和水,故D错误.
故选B.
点评 本题考查有机物的结构和性质,为高频考点,侧重考查学生的分析能力,注意把握有机物的组成、结构和官能团的性质,把握有机物相关概念的理解,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
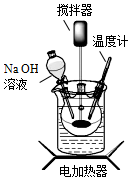 超细Fe3O4粉体可制成磁流体,一种制备超细Fe3O4粉体的实验步骤如下:
超细Fe3O4粉体可制成磁流体,一种制备超细Fe3O4粉体的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热煮沸的主要目的是除去溶液中溶解的氯气 | |
| B. | 稀释过程中用到的玻璃仪器主要有烧杯、玻璃棒、胶头滴管 | |
| C. | 滴定过程中可用KSCN溶液作指示剂 | |
| D. | 铁矿石中铁的质量分数为70% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲为Fe,则丁可能是Cl2 | B. | 若甲为焦炭,则丁可能是O2 | ||
| C. | 若甲为SO2,则丁可能是氨水 | D. | 若甲为NaOH 溶液,则丁可能是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②④⑤ | C. | ①③⑥ | D. | ②⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
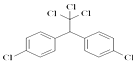 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A. | 属于烃类 | |
| B. | DDT完全燃烧后只产生CO2和H2O两种物质 | |
| C. | 分子无手性碳 | |
| D. | 核磁共振氢谱中显示有2组峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制乙烯时,温度计水银球应插入混合液中,而石油分馏时则不能插入混合液中 | |
| B. | 实验室用溴和苯在铁粉存在下反应,得到的溴苯显褐色,可用稀NaOH溶液反复洗涤,并用分液漏斗分液 | |
| C. | 检验2-溴丙烷中的溴原子:加入NaOH水溶液共热,冷却后,用稀硝酸酸化后再滴入AgNO3溶液,观察有淡黄色沉淀生成 | |
| D. | 制取硝基苯时,应取1.5 mL浓HNO3,加入浓H2SO4 2mL,冷却至50℃以下,再滴入苯约1mL,然后放在水浴中加热,温度计应放在混合液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com