
 A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:
A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:分析 (1)A为金属单质,C、D的相对分子质量相差16,0.05mol/L E溶液中只有3种离子,且且溶液中的$\frac{C(H+)}{C(OH-)}$=1012,则溶液中的c(H+)=0.1mol/L,则E为硫酸,所以A为S,C为SO2,D为SO3,B为气体,应为H2S,E→C应为浓硫酸与铜的反应或浓硫酸与碳的反应,根据元素守恒书写化学方程式,A→C的反应为S(g)+O2(g)═SO2(g),每转移1mol e-就会放热143.5kJ,则转移4mol电子吸收143.5kJ×4=574.0kJ热量,以此书写热化学方程式;
(2)A为单质,B、C均属于盐类,D是一种白色沉淀,若B的水溶液呈酸性,C的水溶液呈碱性.将A的粉末与硝酸钠溶液混合后加入足量40%的氢氧化钠溶液,有无色刺激性气味的气体生成,用湿润的红色石蕊试纸检验,试纸变蓝,该气体为氨气,由转化关系可知A为Al,C为NaAlO2,D为Al(OH)3;
若B溶液呈黄色,与苯酚溶液混合后显紫色,可说明B中含有Fe3+,A应为Fe,C中含有Fe2+,E是一种不溶性碱,由转化关系可知D为Fe(OH)2,E为Fe(OH)3;
(3)A-E均为化合物,A是淡黄色固体,A为Na2O2;B、C两溶液在等物质的量浓度时,C溶液的pH较小,B为Na2CO3,C为NaHCO3,电解D的水溶液是最重要的工业生产之一,D应为NaCl,D→E→C也是工业制备C的普遍方法,为侯氏制碱法,E为NaOH,据此答题.
解答 解:(1)A为金属单质,C、D的相对分子质量相差16,0.05mol/L E溶液中只有3种离子,且且溶液中的$\frac{C(H+)}{C(OH-)}$=1012,则溶液中的c(H+)=0.1mol/L,则E为硫酸,所以A为S,C为SO2,D为SO3,B为气体,应为H2S,
①E→C的化学方程式为Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O或C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O或C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O;
②A→C的反应为S(g)+O2(g)═SO2(g),每转移1mol e-就会放热143.5kJ,则转移4mol电子吸收143.5kJ×4=574.0kJ热量,则反应的热化学方程式为S(g)+O2(g)═SO2(g)△H=-574.0 kJ/mol,
故答案为:S(g)+O2(g)═SO2(g)△H=-574.0 kJ/mol;
(2)①A为单质,B、C均属于盐类,D是一种白色沉淀,若B的水溶液呈酸性,C的水溶液呈碱性,则由转化关系可知A为Al,B为AlCl3,C为NaAlO2,D为Al(OH)3,B溶液呈酸性的原因是铝离子水解使溶液呈酸性,离子方程式为Al3++3H2O?Al(OH)3+3H+,
故答案为:Al3++3H2O?Al(OH)3+3H+;
②若B溶液呈黄色,与苯酚溶液混合后显紫色,可说明B中含有Fe3+,A应为Fe,C中含有Fe2+,E是一种不溶性碱,由转化关系可知D为Fe(OH)2,E为Fe(OH)3,B→C的离子方程式为2Fe3++Fe═3Fe2+,D→E的化学方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3,用HI与Fe(OH)3反应,反应的离子方程式为2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O,
故答案为:2Fe3++Fe═3Fe2+;4Fe(OH)2+O2+2H2O═4Fe(OH)3;2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O;
(3)A-E均为化合物,A是淡黄色固体,A为Na2O2;B、C两溶液在等物质的量浓度时,C溶液的pH较小,B为Na2CO3,C为NaHCO3,电解D的水溶液是最重要的工业生产之一,D应为NaCl,D→E→C也是工业制备C的普遍方法,为侯氏制碱法,E为NaOH,等浓度、等体积混合的C、E两溶液中所有离子浓度的大小关系为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
点评 本题考查无机物的推断,注意利用信息及转化关系图推断各物质是解答的关键,习题综合性较强,涉及热化学反应、离子反应及溶液中物料守恒、电荷守恒的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
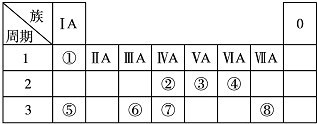
 ,
,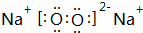 .若用球棍模型表示①和④形成的化合物的分子结构,应该是下图中的B.
.若用球棍模型表示①和④形成的化合物的分子结构,应该是下图中的B.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 属于芳香烃 | B. | 分子中苯环上的一氯代物有3种 | ||
| C. | 不能与金属钠发生反应 | D. | 不能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4分子的比例模型: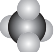 | B. | CO2的电子式:O::C::O | ||
| C. | Cl-的离子结构示意图: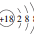 | D. | 中子数为18的硫原子:${\;}_{16}^{18}$S |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2O2中既含离子键又含非极性键 | |
| B. | BF3分子中的所有原子共平面 | |
| C. | SiO2和Na2O2的晶体类型相同 | |
| D. | S的第一电离能大于P的第一电离能. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的CH3COOH溶液中:c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1mol•L-1的NaHCO3溶液中:c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 0.1mol•L-1的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1的NH4Cl溶液中:c(NH4+)+c(H+)=c(NH3•H2O)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,分子式:C3H4N2,与苯有类似结构和性质.有关它的说法错误的是( )
,分子式:C3H4N2,与苯有类似结构和性质.有关它的说法错误的是( )| A. | 是芳香族化合物 | |
| B. | 能发生加成、取代、氧化反应 | |
| C. | 每个分子中有9个σ键 | |
| D. | 分子极性键又含有非极性键中既含有 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 石墨烯是由碳原子构成的单层片状结构的新材料(如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )
石墨烯是由碳原子构成的单层片状结构的新材料(如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )| A. | 石墨烯与金刚石互为同位素 | |
| B. | 0.12g石墨烯中含有6.02×1021个碳原子 | |
| C. | 石墨烯中的碳原子间以共价键结合 | |
| D. | 石墨烯是一种新型有机物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com