
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
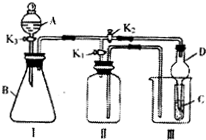
 如图所示装置可用于多种实验.
如图所示装置可用于多种实验.

查看答案和解析>>
科目:高中化学 来源: 题型:
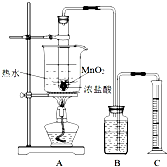 实验室常用浓盐酸与二氧化锰反应制取氯气.浓盐酸和二氧化锰反应过程中,浓盐酸的浓度不断降低,当盐酸浓度降至临界浓度时,反应停止.
实验室常用浓盐酸与二氧化锰反应制取氯气.浓盐酸和二氧化锰反应过程中,浓盐酸的浓度不断降低,当盐酸浓度降至临界浓度时,反应停止.| 第一次实验 | 第二次实验 | 第三次实验 | |
| 盐酸的用量 | 10.0mL | 10.0mL | 10.0mL |
| 氯气的体积 | 225mL | 192mL | 223mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
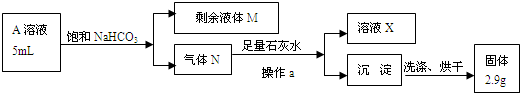
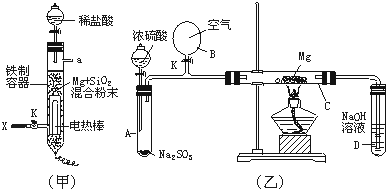
 某小组设计如图装置:可用于制取多种气体,也可用于验证物质的性质.
某小组设计如图装置:可用于制取多种气体,也可用于验证物质的性质.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 点燃 |
| 点燃 |
| 点燃 |
| 点燃 |
| 点燃 |
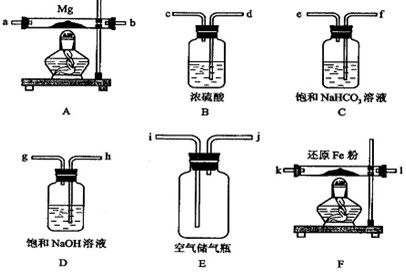
| △ |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com