
���� ��1�����淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ���Ӧ��ϵ�и����ʵ����ʵ��������ʵ���Ũ�ȡ��ٷֺ����Լ��ɴ������һϵ�����������䣻
��2����Ӧ��ʼʱc��H2��=$\frac{4amol}{2L}$=2amol/L��c��CO��=$\frac{2amol}{2L}$=amol/L����ַ�Ӧ����CO��ת����Ϊ50%����μӷ�Ӧ��c��CO��=amol/L��50%=0.5amol/L��
�÷�ӦCO��g��+2H2��g��?CH3OH��g��
��ʼ��mol/L��a 2a 0
��Ӧ��mol/L��0.5a a 0.5a
ƽ�⣨mol/L��0.5a a 0.5a
��ѧƽ�ⳣ��K=$\frac{c��C{H}_{3}OH��}{c��CO����{c}^{2}��{H}_{2}��}$��
����ʱ�����������Ͷ��a mol CO��2amol H2��amol CH3OH������ʱ�����������Ͷ��a mol CO��2a mol H2��a mol CH3OH��Ũ��Ϊc��CO��=0.5amol/L+0.5amol/L=amol/L��c��H2��=amol/L+amol/L=2amol/L��c��CH3OH��=0.5amol/L+0.5amol/L=amol/L������Ũ�����뻯ѧƽ�ⳣ����Դ�Сȷ����Ӧ���Ӷ�ȷ��COŨ�ȱ仯��
��� �⣺��1��A����v��H2�����棩=2v��CO��������ʱ���÷�Ӧ�ﵽƽ��״̬����2v��H2�����棩=v��CO��������ʱ�÷�Ӧû�дﵽƽ��״̬���ʴ���
B�����۷�Ӧ�Ƿ�ﵽƽ��״̬����Ӧǰ�������������䡢����������䣬����������ܶ�ʼ�ղ��䣬���ܾݴ��ж�ƽ��״̬���ʴ���
C����Ӧǰ���������ʵ�����С����������������䣬���������ƽ����Է������������������ƽ����Է�����������ʱ�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬������ȷ��
D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯ʱ�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬������ȷ��
E��������CO��H2��CH3OH��Ũ��֮��Ϊ1��2��1ʱ���÷�Ӧ��һ���ﵽƽ��״̬���뷴Ӧ��ʼŨ�ȼ�ת�����йأ��ʴ���
��ѡCD��
��2����Ӧ��ʼʱc��H2��=$\frac{4amol}{2L}$=2amol/L��c��CO��=$\frac{2amol}{2L}$=amol/L����ַ�Ӧ����CO��ת����Ϊ50%����μӷ�Ӧ��c��CO��=amol/L��50%=0.5amol/L��
�÷�ӦCO��g��+2H2��g��?CH3OH��g��
��ʼ��mol/L��a 2a 0
��Ӧ��mol/L��0.5a a 0.5a
ƽ�⣨mol/L��0.5a a 0.5a
��ѧƽ�ⳣ��K=$\frac{c��C{H}_{3}OH��}{c��CO����{c}^{2}��{H}_{2}��}$=$\frac{0.5a}{0.5a��{a}^{2}}$=$\frac{1}{{a}^{2}}$��
����ʱ�����������Ͷ��a mol CO��2amol H2��amol CH3OH������ʱ�����������Ͷ��a mol CO��2a mol H2��a mol CH3OH��Ũ��Ϊc��CO��=0.5amol/L+0.5amol/L=amol/L��c��H2��=amol/L+amol/L=2amol/L��c��CH3OH��=0.5amol/L+0.5amol/L=amol/L��Ũ����Q=$\frac{a}{a����2a��^{2}}$=$\frac{1}{4{a}^{2}}$��$\frac{1}{{a}^{2}}$������ƽ�������ƶ���ƽ��ʱCOŨ������
�ʴ�Ϊ��$\frac{1}{{a}^{2}}$�������ƶ�������
���� ���⿼�黯ѧƽ����㼰��ѧƽ��״̬�жϣ����ؿ���ѧ�����㼰�ж���������ȷƽ�ⳣ�����㷽����Ũ�����뻯ѧƽ�ⳣ����Դ�С�ͷ�Ӧ�����ϵ�ǽⱾ��ؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ղ��ù��������������ó����ֺ���ɫ�� | |
| B�� | ��ú����ȼ����Ȼ��Ϊ�����ṩ���� | |
| C�� | ţ�̾��ÿ����б��ʸ��� | |
| D�� | ���ˮ�е���FeCl3������Һ���ʵ����ȣ��Ʊ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��Fe3+��=0.1 mol•L-1����Һ�У�K+��ClO-��SO42-��SCN- | |
| B�� | $\frac{c��{H}^{+}��}{c��O{H}^{-}��}$=1012����Һ�У�NH4+��Al3+��NO3-��Cl- | |
| C�� | ��ˮ���������c��OH-��=1��10-13mol/L����Һ�У�Ca2+��K+��Cl-��HCO3- | |
| D�� | pH=1����Һ�У�Fe2+��NO3-��SO42-��Na+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2���SO2������O2��Ӧ��һ����������2���SO3 | |
| B�� | �����������䣬����ѹǿ������Ӧ���������淴Ӧ����Ҳ���� | |
| C�� | ����2molSO2��1molO2�ų��������Ǽ���1molSO2��0.5molO2�ų�������2�� | |
| D�� | �ڸ���������Ͷ��1molSO3��ƽ����ټ���1molSO3������ƽ���SO2�����������ԭƽ���С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
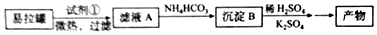
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
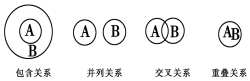
| A�� | ���������������ڰ�����ϵ | |
| B�� | ������ԭ��Ӧ�뻯�Ϸ�Ӧ���ڰ�����ϵ | |
| C�� | ��Һ���ɢϵ���ڲ��й�ϵ | |
| D�� | ��������������������ڽ����ϵ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| �¶ȡ� | 700 | 800 | 880 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.0 | 10.0 | 15.0 | 16.1 | 17.7 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com