
研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义。请运用相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:______C+________K2Cr2O7+________——________CO2↑+________K2SO4+________Cr2(SO4)3+________H2O。
①完成并配平上述化学方程式。
②在上述化学方程式上标出该反应电子转移的方向与数目。
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是_________________________________________________________。
②由MgO可制成“镁-次氯酸盐”燃料电池,其装置示意图如图(a)所示,该电池反应的离子方程式为________________________________________。

(a) (b) (c)
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH。
CH3OH(g)+H2O(g) ΔH。
①该反应的平衡常数表达式为K=________。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图(b)所示,则上述CO2转化为甲醇反应的ΔH________(填“>”“<”或“=”)0。
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图(c)所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“>”“<”或“=”)。
(1)①3 2 8 H2SO4 3 2 2 8
② +8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
(2)①2MgSO4+CO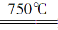 2MgO+SO2+CO2+SO3
2MgO+SO2+CO2+SO3
②Mg+ClO-+H2O=Cl-+Mg(OH)2
(3)①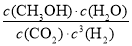 ②< ③>
②< ③>
【解析】(1)①反应中C→CO2,化合价升高4,K2Cr2O7→Cr2(SO4)3,化合价降低6,根据得失电子守恒、质量守恒定律即可配平反应的化学方程式。
②得失电子的最小公倍数为12,用单线桥或双线桥表示均可,单线桥表示如下:
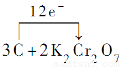 +8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。
+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。
(2)①CO作还原剂,反应中CO→CO2,化合价升高2,MgSO4→SO2,化合价降低2,据此即可配平化学方程式。
②从图(a)可知,放电时Mg→Mg(OH)2,化合价升高2;ClO-+H2O→Cl-+OH-,化合价降低2,由此可配平反应的化学方程式。
(3)①平衡常数为生成物浓度幂之积与反应物浓度幂之积的比值。
②从图(b)的最高点(平衡点)之后看,随着反应的进行,升高温度,平衡逆向移动,故正反应为放热反应,ΔH<0。
③从图(c)看,反应Ⅰ中生成甲醇的物质的量大于反应Ⅱ中生成甲醇的物质的量,说明Ⅰ条件下有利于平衡正向移动,平衡常数大。


科目:高中化学 来源:2014年高考化学指导冲关 第12练物质制备方案的设计与评价练习卷(解析版) 题型:选择题
下列操作不能达到目的的是( )
选项目的操作
A配制100 mL
1.0 mol·L-1CuSO4溶液将25 g CuSO4·5H2O
溶于100 mL蒸馏水中
B除去KNO3
中少量NaCl将混合物制成热的饱和
溶液,冷却结晶,过滤
C在溶液中将MnO4—
完全转化为Mn2+向酸性KMnO4溶液
中滴加H2O2溶液至紫色消失
D确定NaCl溶液中是
否混有Na2CO3取少量溶液滴加CaCl2
溶液,观察是否出现白色浑浊
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习指导预测押题练习卷(二) (解析版) 题型:选择题
工业上可用硫酸铝与硫黄焙烧制备氧化铝:2Al2(SO4)3+3S  2Al2O3+9SO2↑,下列有关说法中正确的是( )
2Al2O3+9SO2↑,下列有关说法中正确的是( )
A.反应中Al2(SO4)3被氧化
B.Al2(SO4)3、Al2O3均含有离子键和共价键
C.5.1 g Al2O3含有9.03×1022个阴离子
D.该反应中,每转移0.3 mol电子生成5.04 L SO2
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习指导预测押题练习卷(一) (解析版) 题型:填空题
已知:A、B、C、D为周期表1~36号中的元素,它们的原子序数逐渐增大。A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;D的基态原子的M电子层上有4个未成对电子。
请回答下列问题:
(1)D是元素周期表中第________周期,第________族的元素;其基态原子的外围电子排布式为________。
(2)A、B、C、D四种元素中,电负性最大的是________(填元素符号)。
(3)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为________。B的氢化物的沸点远高于A的氢化物的沸点的主要原因是________________________________________________________________。
(4)D能与AC分子形成D(AC)5,其原因是AC分子中含有________________。D(AC)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断D(AC)5晶体属于________(填晶体类型)。
(5)SiO2的晶胞可作如下推导:先将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成Si原子,再在每两个不共面的“小立方体”中心处各放置一个Si原子便构成了晶体Si的一个晶胞。再在每两个相邻的Si原子(距离最近的两个Si原子)中心连线的中点处增添一个O原子,便构成了SiO2晶胞,故SiO2晶胞中有________个Si原子,________个O原子。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习指导预测押题练习卷(一) (解析版) 题型:选择题
已知Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH<0;则下列叙述不正确的是( )
A.该反应的ΔH值与反应物用量无关
B.该反应的化学能可以转化为电能
C.反应物的总能量高于生成物的总能量
D.该反应中反应物的化学键断裂放出能量,生成物化学键形成吸收能量
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:选择题
已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用如图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是( )
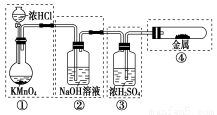
A.①② B.② C.②③ D.②③④
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:选择题
在下列溶液中,各组离子一定能够大量共存的是( )
A.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br-
B.常温下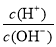 =1012的溶液:Fe2+、Mg2+、NO3-、Cl-
=1012的溶液:Fe2+、Mg2+、NO3-、Cl-
C.含有大量Al3+的溶液:Na+、Cl-、AlO2-、OH-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练2 化学基本理论练习卷(解析版) 题型:填空题
臭氧可用于净化空气、饮用水的消毒、处理工业废物和作漂白剂。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s) ΔH=-235.8 kJ·mol-1。已知2Ag2O(s)=4Ag(s)+O2(g) ΔH=+62.2 kJ·mol-1,则常温下反应2O3(g)=3O2(g)的ΔH=________。
(2)配平下面反应的化学方程式(将各物质的化学计量数填在相应的方框内):
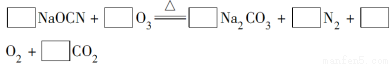
(3)科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,电极反应式为3H2O-6e-=O3↑+6H+,阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为_______________________。
(4)空气中臭氧的检测方法是将空气慢慢通过足量KI淀粉溶液,若溶液变蓝色,则说明空气中含有O3。已知O3与KI溶液反应生成两种单质,则该反应的离子方程式为_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷二(解析版) 题型:选择题
下列说法正确的是( )
A.乙烯和乙烷都能发生加聚反应
B.蛋白质水解的最终产物是多肽
C.米酒变酸的过程涉及了氧化反应
D.石油裂解和油脂皂化都是由高分子生成小分子的过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com