
| ||
| ||
| ||
| ||
| 0.4mol |
| 2 |
| 0.4mol |
| 4 |


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
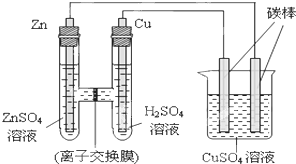
同步奥数系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
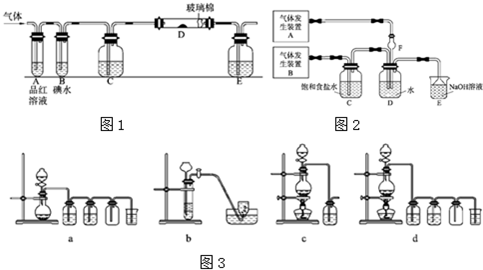
科目:高中化学 来源: 题型:
 (1)装药品前,应先进行的操作
(1)装药品前,应先进行的操作| H2 | O2 | |
| ① | Zn、稀盐酸 | KClO3、MnO2 |
| ② | Zn、稀硫酸 | H2O2溶液、MnO2 |
| ③ | Zn、稀硝酸 | KMnO4 |
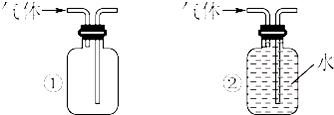
查看答案和解析>>
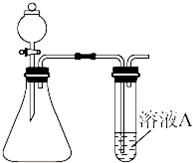
科目:高中化学 来源:2012-2013年江苏南京学大教育专修学校高二3月月考化学试卷(带解析) 题型:实验题
(Ⅰ)溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。
(1)写出溴乙烷在NaOH水溶液中的反应方程式:
反应类型 。某同学取少量溴乙烷与NaOH水溶液反应后的混合溶液,向其中滴加AgNO3溶液,加热,产生少量沉淀。该同学由此得出溴乙烷与NaOH水溶液反应,生成了溴化钠,你认为是否合理,原因: 。
(2)写出溴乙烷在NaOH乙醇溶液中的反应方程式 反应类型 。反应中生成的气体可以用下图所示装置检验,现象是 ,水的作用是 。除高锰酸钾酸性溶液外,还可以用 检验生成的气体,此时还有必要将气体先通入水中吗? (填“有”或“没有”) 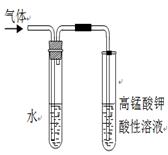
(Ⅱ)下面是实验室制乙烯并检验其性质的装置图,请回答: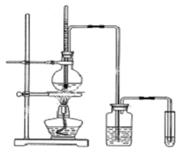
(1)写出圆底烧瓶中反应的方程式 ,
反应类型_______________;
(2)烧瓶中混合液逐渐变黑,并产生某些无机杂质气体,写出产生杂质气体的化学方程式:
;
(3)为了检验乙烯的生成,试管中应盛放 ,
现象为 ;
(4)洗瓶中盛放的试剂为 ,作用________________________________。
(Ⅲ)某学习小组同学为了确定盐酸 、苯酚、碳酸的酸性强弱,设计了如图所示的装置图进行实验: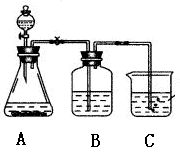
(1)锥形瓶内装某可溶性盐,写出A中反应的离子方程式:
;
(2)C中的现象为 ,写出C中反应的化学方程式:_____________;
(3)B中的试剂为 ,作用 。
查看答案和解析>>
科目:高中化学 来源:2010届湖北省高三11月月考化学测试卷 题型:实验题
(10分)以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。

①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若置D装的是铁粉,通入Cl2与铁粉充分反应时现象为
;若装置D中装的是五氧化二钒(催化剂)。通入SO2时,打开K通入适量O2的化学反应方程式为 。
②若装置B中装有5.0 mL 1.0×10-3mol/L在碘水,当通入足量Cl2完全反应后,共转移了5.0×10-5mol电子,该反应的化学方程式为 。
③E中盛有 溶液。
(2)某同学将足量的SO2通入一支装有氧化钡溶液的试管,未见沉淀生成,若向该试管中加入加量(填字母) ,则可以看到白色沉淀产生。
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2的与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com