
为提高物质、能源利用率,化学工业近年提出共生工程,工业生产活动应尽可能多功能化。比如以硫酸工业的尾气、氨水、石灰石、焦炭、碳酸氢铵及氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
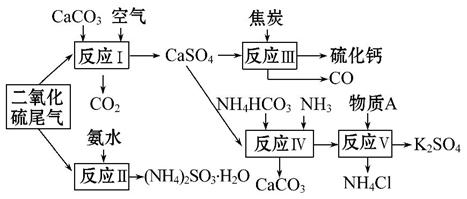
(1)除了可用于制备其他物质,SO2还可用于_________________;
(2)反应Ⅴ的原料A是________(填化学式);
(3)反应Ⅲ生成1 mol CaS转移的电子数为_________________________;
(4)生产中,向反应Ⅱ的溶液中加入适量还原性很强的对苯二酚等物质,其目的是________________________________________。
产物(NH4)2SO3可用于电厂等烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式____________________________________;
(5)反应Ⅳ是往CaSO4悬浊液中加入碳酸氢铵、通入氨气,控制在60℃~70℃左右搅拌,温度太高和太低的不足分别是______________________________。
已知25℃时,Ksp(CaSO4)=7.10×10-5。向0.100 L含CaSO4固体的溶液中加入
2.22 g CaCl2粉末充分搅拌,假设溶液的体积变化忽略不计,所得溶液中c(S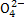 )=__________。
)=__________。
【解析】(1)根据SO2的性质可得知SO2还可用于漂白。
(2)反应Ⅳ是CaSO4、NH4HCO3、NH3反应生成CaCO3和(NH4)2SO4,因此反应Ⅴ是物质A和(NH4)2SO4反应生成K2SO4和NH4Cl,故根据元素守恒可推知A为KCl。
(3)反应Ⅲ是CaSO4+C→CO+CaS,其中硫元素由+6价降低为-2价,故生成1 mol CaS转移的电子的物质的量为8 mol。
(4)反应Ⅱ中得到的产品是(NH4)2SO3·H2O,而+4价的硫具有较强的还原性易被氧化,所以加入还原性较强的对苯二酚的作用是防止+4价的硫被氧化。
(5)由于NH4HCO3受热易分解,故温度太高会导致NH4HCO3分解,而温度太低会使反应的速率太小,不利于反应进行。
2.22 g CaCl2的物质的量为0.02 mol,所以有
Ksp(CaSO4)=7.10×10-5=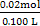 ×c(S
×c(S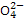 ),解得c(S
),解得c(S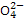 )=3.55×10-4mol·L-1。
)=3.55×10-4mol·L-1。
答案:(1)漂白 (2)KCl (3)8NA
(4)防止+4价硫(S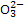 )被氧化
)被氧化
2NO2+4(NH4)2SO3====N2+4(NH4)2SO4
(5)温度太高引起碳酸氢铵的分解;温度太低化学反应速率太小 3.55×10-4mol·L-1


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
如图所示实验装置用于验证某些物质的性质。在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片。试回答下列问题:
(1)在A试管内发生反应的化学方程式是_______________。
(2)B装置的作用是____________________________________________。
(3)在双球干燥管内发生反应的化学方程式为____________________________。
(4)双球干燥管内观察到的实验现象是__________________________________,上述实验现象说明____________________________________________________。
(5)若将干燥管内的Na2O2换成Na2O,则对于点燃的蚊香观察到的实验现象是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有下述有机反应类型:①消去反应 ②水解反应 ③加聚反应 ④加成反应 ⑤还原反应 ⑥氧化反应。已知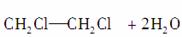
 CH2OH—CH2OH+2HCl,以丙醛为原料制取1,2丙二醇,所需进行的反应类型依次是( )
CH2OH—CH2OH+2HCl,以丙醛为原料制取1,2丙二醇,所需进行的反应类型依次是( )
A.⑥④②① B.⑤①④②
C.①③②⑤ D.⑤②④①
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
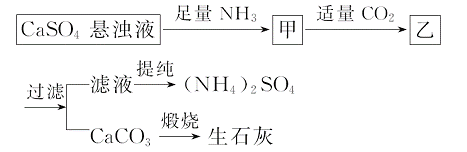
下列推断不合理的是( )
A.直接蒸干滤液得到纯净的(NH4)2SO4
B.生成1 mol(NH4)2SO4至少消耗2 mol NH3
C.CO2可循环使用
D.往甲中通CO2有利于(NH4)2SO4生成
查看答案和解析>>
科目:高中化学 来源: 题型:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为第 周期、
第 族,PbO2的酸性比CO2的酸性 (填“强”“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得反应的离子方程式为 ;
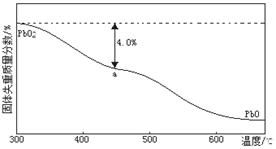
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%( )的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,则计算x= 值和m:n= 。
)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,则计算x= 值和m:n= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
.已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是 ( )
A.能使pH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存
B.惰性电极电解氯化镁溶液: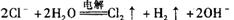
C.NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+ H2O 2HClO+CO32-
D.向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中K+、Fe2+、SCN-、Br-可以大量存在
B.和KI溶液反应的离子方程式: Fe3++2I- =Fe2++I2
C.和Ba(OH)2溶液反应离子方程式:Fe3++ SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓
D. 1 L0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2g Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
25。C时,下列各组离子在指定溶液中能大量共存的是
A. 滴入甲基橙显红色的溶液中:NH4+、Ba2+、AlO2-、Cl-
B. PH=13的溶液:Na+、K+、SiO32-、HCO3-
C. 含较多SO32-的溶液:H+、Ca2+ 、Fe3+、NO3-
D. 澄清透明溶液中:K+、MnO4-、H2O、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com