
| A、H2S?2H++S2- |
| B、HClO=H++ClO- |
| C、CH3COONa=Na++CH3COO- |
| D、NaHCO3?Na++HCO3- |


科目:高中化学 来源: 题型:
| A、将SO2通入BaCl2溶液中 |
| B、将NH3通入AgNO3溶液中 |
| C、将Cl2通入AgNO3溶液中 |
| D、将NO2通入Ca(OH)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a c f h |
| B、a c e g |
| C、a c e f h |
| D、b d e h |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、23g NO2和N2O4的混合气体中含有的氮原子数为0.5NA |
| B、标准状况下,2.24L乙醇中含有的C-H数目为0.5NA |
| C、1mol?L-1的NaClO溶液中所含ClO-的数目为NA |
| D、室温下H2O2分解得到16g O2,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
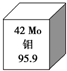 我国安徽发现了全国最大的钼矿,如图是钼元素的相关信息,下列有关钼的说法错误的是( )
我国安徽发现了全国最大的钼矿,如图是钼元素的相关信息,下列有关钼的说法错误的是( )| A、95Mo原子核内有53个中子 |
| B、95Mo原子核外有42个电子 |
| C、92Mo、95Mo、98Mo互为同位素 |
| D、92Mo、95Mo、98Mo的化学性质有较大的不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO
| ||||
B、用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-
| ||||
| C、NaOH溶液不能保存在玻璃塞的试剂瓶中:SiO2+2OH-=SiO32-+H2O | ||||
| D、向滴有酚酞的氨水中加入盐酸,红色逐渐褪去:H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去硫酸铜溶液中的硫酸亚铁以最终制备胆矾晶体:2Fe2++Cl2=2Fe3++2Cl- |
| B、在含有Mn2+的溶液中加入HNO3酸化,再加入PbO2,反应体系显紫红色,5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O |
| C、向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4+NH3?H2O+H2O |
| D、氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.8g重水(D2O)中含NA个中子 |
| B、NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
| C、标准状况下,含有NA个分子的氧气和氮气的混和气体的体积约为22.4L |
| D、制取漂白粉的反应中,每消耗7.1g Cl2,则转移0.2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com