
 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑ Mg(OH)2↓+Cl2↑+H2↑,故A错误;
Mg(OH)2↓+Cl2↑+H2↑,故A错误;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:黑龙江省牡丹江一中2010-2011学年高二下学期期末考试化学试题 题型:058
(1)2003年夏,全球化学家投票评选了化学史上十项最美的实验,1848年巴斯德用手工在光学显微镜下把左型酒石酸盐晶体和右型酒石酸盐晶体分开的实验被选为十项之首.请回答下列问题:
a.左型酒石酸盐晶体和右型酒石酸盐晶体的关系是________.
b.下列化合物中具有与左,右型酒石酸盐的关系相同的是________.
(用序号表示)
①丙烯酸甲酯
②葡萄糖
③CHClBrCH2F2
④甘油
⑤2-氨基丙酸
⑥乳酸
(2)化学是一个美丽的学科,她向我们展示了微观世界中分子原子的规律.根据无机含氧酸的酸性规律,将下列四种无机含氧酸按酸性相近两两组成一组,它们是________和________,________和________.(用序号表示)
①H3PO4
②HClO
③H3BO3
④HNO2
(3)过渡元素可谓是藏龙卧虎,那里有熔点最高的钨,有贵重金属金,某元素的基态原子的正三价离子的3d能级为半充满状态.检验该离子常用试剂是________,反应的离子方程式为________,正三价离子外围电子排布图是________.钛被称为未来金属,钛的化合物TiCl3·6H2O(相对分子质量为262.5)配位数为6,取该晶体26.25克配成溶液,加入足量硝酸银溶液,过滤,洗涤,烘干,称重,沉淀为28.70克,则该晶体的化学式应表示为________.
(4)甲烷晶体晶胞结构如图,与一个甲烷分子紧密相邻的甲烷分子有________个.

查看答案和解析>>
科目:高中化学 来源: 题型:
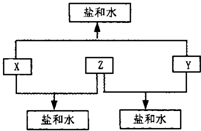
某常见金属X,有下列关系图,其中A、B分别是X的正二价、正三价金属离子,请回答:

(1)写出X的名称 ,Y的化学式 。
(2)写出下列反应的化学方程式或离子方程式:
① X和稀盐酸反应生成A和某种气体的离子方程式
② +2价的A被Y氧化反应生成+3价的B的离子方程式
③ X粉末和硫酸铜溶液发生置换反应的离子方程式
④ X的正三价氧化物(X2O3)和铝粉反应的化学方程式
(3)A溶液与NaOH溶液在空气中反应的现象 。
并写出有关的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年广西北海市合浦县教研室高二上学期期末考试化学试卷 题型:填空题
某常见金属X,有下列关系图,其中A、B分别是X的正二价、正三价金属离子,请回答:
(1)写出X的名称 ,Y的化学 式 。
式 。
(2)写出下列反应的化学方程式或离子方程式:
① X和稀盐酸反应生成A和某种气体的离子方程式
② +2价的A被Y氧化反应生成+3价的B的离子方程式
③ X粉末和硫酸铜溶液发生置换反应的离子方程式

④ X的正三价氧化物(X2O3)和铝粉反应的化学方程式
(3)A溶液与NaOH溶液在空气中反应的现象  。
。
并写出有关的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闸北区高三上学期期末考试化学试卷(解析版) 题型:填空题
铁及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH-→Fe3O4↓+S4O32-+2H2O
①上述离子方程式中x=________;
②每生成1 mol Fe3O4,反应转移的电子为________mol;
(2)某高效净水剂可由Fe(OH)SO4聚合得到。工业上以FeSO4、NaNO2和稀硫酸为原料来制备Fe(OH)SO4,反应中有NO生成,化学方程式为 。
高炉炼铁过程中发生的主要反应为: Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)

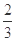 Fe(s)+CO2(g)+Q
Fe(s)+CO2(g)+Q
已知该反应在不同温度下的平衡常数如下:
|
温度/℃ |
1000 |
1115 |
1300 |
|
平衡常数 |
4.0 |
3.7 |
3.5 |
(3)该反应的平衡常数表达式K=_ ;Q 0(填“>”、“<”或“=”);
(4)欲提高上述反应中CO的平衡转化率,可采取的措施是 ;
A.提高反应温度 B.移出部分CO2
C.加入合适的催化剂 D.减小容器的容积
(5)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,此时v正 v逆(填“等于”、“大于”或“小于”)。经过l0 min,在1000℃达到平衡,则该时间范围内反应的平均反应速率v (CO2)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com