
下列说法正确的是
A. 向氨水中不断通入CO2,随着CO2的增加,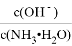 不断减小
不断减小
B. 在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu
C. 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的△H>0,△S<0
D. 将下图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深

科目:高中化学 来源:2016-2017学年江西省新余市高二下学期入学考试化学试卷(解析版) 题型:选择题
一种新燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料说法正确的是 ( )
A. 在熔融电解质中,O2-由负极移向正极
B. 电池的总反应是:2C4H10 + 13O2 → 8CO2 + 10H2O
C. 通入空气的一极是正极,电极反应为:O2 + 4e- 2H2O= 4OH-
D. 通入丁烷的一极是正极,电极反应为:C4H10 + 26e- + 13O2- = 4CO2 + 5H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省葫芦岛市高一下学期选拔考试化学试卷(解析版) 题型:实验题
如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)
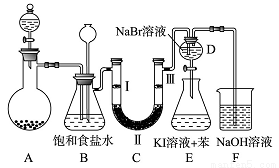
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的离子反应方程式为:_____________.装置 B 中饱和食盐水的作用是_________________;
若C处发生了堵塞,则B中的现象为__________________.
(2)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中Ⅰ、Ⅱ、Ⅲ应该依次放入____(填编号)
① | ② | ③ | ④ | |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为______色,说明 ________________;打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是__________________;
(4)如果将二氧化锰与足量的浓盐酸混合加热,若有17.4g 的 MnO2 被还原,则被氧化的 HCl 的质量为_____.
(5)向 Na2CO3 溶液中通入氯气,可制得某种生产和生活中常用的漂白液,同时有 NaHCO3 生成,该反应的化学方程式是______.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省葫芦岛市高一下学期选拔考试化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A. 1mol FeI2与足量氯气反应时转移的电子数为2NA
B. 2L 0.5mol•L﹣1硫酸钾溶液中阴离子所带电荷数为NA
C. 1mol Na2O2固体中含离子总数为4NA
D. 22gCO2与标准状况下11.2LHCl所含的分子数相同
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:简答题
七铝十二钙是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
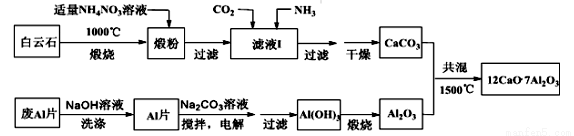
(1)煅粉主要含__________,该工艺中不能用(NH4)2SO4代替NH4NO3,原因是_________。
(2)滤液I中主要的阴离子有_________;若滤液I中仅通入CO2,会生成________,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为______________。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为_______________。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式书写正确的是
A. 电解饱和氯化镁溶液:2Cl-+2H2O H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
B. Fe(OH)3溶于氢碘酸:Fe(OH)3+ 3H+=Fe3++3H2O
C. NaAlO2溶液中 AlO2-的水【解析】
AlO2-+2H2O=Al(OH)3+ OH-
D. 向KAl(SO4)2溶液中加过量的Ba(OH)2溶液:Al3++2SO42- +2Ba2++4 OH-= AlO2-+2BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省凯里市高二下学期开学考试理综化学试卷(解析版) 题型:简答题
铜是人类最早使用的金属之一,中国使用铜的历史年代久远。大约在六、七千年以前中国人的祖先就发现并开始使用铜。纯铜是柔软的金属,呈紫红色,延展性好,导热性和导电性高,因此在电缆和电气、电子元件是最常用的材料,请回答下列问题:
(1)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_______(填选项字母)
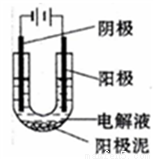
a.粗铜接电源正极,发生氧化反应
b.溶液中Cu2+向阴极移动
c.电解过程中,阳极和阴极的质量变化相等
d.利用阳极泥可回收Al、Zn等金属
(2)目前的电路板,主要由线路和图面组成,线路是作为原件之间导通的工具,在设计上会另外设计大铜面作为接地及电源层,在印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为______________。
(3) Cu不活泼,通常情况下不与稀硫酸反应,但向Cu和稀硫酸的混合物中滴入H2O2溶液后,溶液很快变蓝色,试写出该反应的离子方程式___________________。
(4)Cu2O中的Cu+不稳定,向Cu2O滴加稀硫酸,有紫红色物质生成,溶液变为蓝色,写出反应的离子方程式_________________。
(5)火法炼铜的原理:Cu2+O2 2Cu+SO2,在改反应中每生成1molCu,转移________mole-。
2Cu+SO2,在改反应中每生成1molCu,转移________mole-。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二下学期开学考试化学试卷(解析版) 题型:选择题
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)  2C(g),达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化的关系如图所示。下列说法正确的是( )
2C(g),达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化的关系如图所示。下列说法正确的是( )
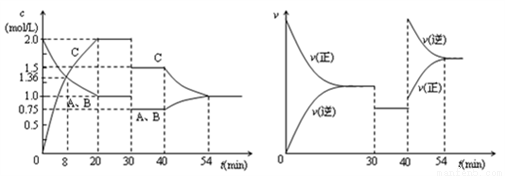
A. 前20min B的平均反应速率为0.05mol·L-1·min-1
B. 8 min时表示正反应速率等于逆反应速率
C. 反应方程式中的x=1,30 min时表示增大压强
D. 40 min时改变的条件是升高温度,且正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源:2016~2017学年江苏省镇江市高二年级学业水平测试(必修)化学试卷(解析版) 题型:选择题
下列关于N2+3 H2  2 NH3的反应说法错误的是
2 NH3的反应说法错误的是
A. 升高温度能加快反应速率
B. 增大压强能加快反应速率
C. 使用恰当的催化剂能加快反应速率
D. 提高H2的浓度能将N2全部转化为NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com