
| 选项 | 实验操作 | 实验目的 |
| A | 将NaOH溶液滴入某溶液中,加热,放出的气体 能使湿润的红色石蕊试纸变蓝 | 证明该溶液中存在NH4+ |
| B | 向某溶液中加入稀盐酸,放出无色气体,将气体通入 澄清石灰水,石灰水变浑浊 | 证明该溶液中存在CO32- |
| C | 将Cl2通入品红溶液中,品红溶液褪色 | 证明Cl2具有漂白性 |
| D | 将酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 证明H2O2氧化性比Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.湿润的红色石蕊试纸变蓝,可知气体为氨气;
B.无色气体为二氧化碳,或二氧化硫;
C.HClO使品红褪色;
D.酸化的溶液中亚铁离子、硝酸根离子发生氧化还原反应.
解答 解:A.湿润的红色石蕊试纸变蓝,可知气体为氨气,则NaOH溶液与铵盐反应生成氨气,可知原溶液中存在铵根离子,故A正确;
B.无色气体为二氧化碳,或二氧化硫,则原溶液中可能存在碳酸根离子或碳酸氢根离子,或亚硫酸根离子等,故B错误;
C.氯气与水反应生成HCl、HClO,HClO使品红褪色,而氯气不具有漂白性,故C错误;
D.酸化的溶液中亚铁离子、硝酸根离子发生氧化还原反应,且硝酸的氧化性大于过氧化氢的氧化性,不能说明过氧化氢氧化亚铁离子,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及离子检验、氧化还原反应、漂白性等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 仪器 |
| A | 用溴水和CCl4除去NaBr溶液中少量NaI | 烧杯、玻璃棒、胶头滴管、分液漏斗 |
| B | 配制100mL l.0mol•L-1的NaOH溶液 | 药匙、天平、量筒、烧杯、玻璃棒、胶头滴管、100mL的容量瓶 |
| C | 从食盐水中获得NaCl晶体 | 酒精灯、玻璃棒、坩埚、泥三角 |
| D | 用盐酸除去BaSO4中混有的少量BaCO3 | 漏斗,烧杯、玻璃棒、胶头滴管、滤纸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下表各组物质中,通过一步反应不能实现如图所示转化的是( )
下表各组物质中,通过一步反应不能实现如图所示转化的是( )| 选项 | a | b | c |
| A | Al2O3 | NaAlO2 | Al(OH)3 |
| B | CO2 | Na2CO3 | NaHCO3 |
| C | NO | NO2 | HNO3 |
| D | Fe2O3 | FeCl3 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 分子间作用力比化学键弱得多,但它对物质熔点、沸点有较大影响,而对溶解度无影响 | |
| D. | ${\;}_{\;}^{14}$C可用于文物年代的鉴定,${\;}_{\;}^{14}$C与${\;}_{\;}^{12}$C互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 运用化学反应原理研究部分单质及其化合物的反应有重要意义.
运用化学反应原理研究部分单质及其化合物的反应有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.8mol/L | D. | 1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
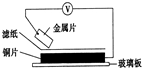
| A. | 若金属片为锌片,溶液为稀硫酸,则电子由铜片流向锌片 | |
| B. | 若金属片为铁片,溶液为氯化钠,则正极发生的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 若金属片为铁片,溶液为氯化钠,为防止铁片发生吸氧腐蚀,可以将铜片换成锡片 | |
| D. | 若滤纸浸有盐溶液,金属片分别用锌片和铁片接入,伏特表“示数”接入锌片的大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com