
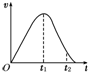
 把除去氧化膜的镁条放入盛有一定浓度的稀盐酸的试管中,发现H2的生成速率v随时间t的变化关系如图所示.其中O~t1段速率变化的主要因素是
把除去氧化膜的镁条放入盛有一定浓度的稀盐酸的试管中,发现H2的生成速率v随时间t的变化关系如图所示.其中O~t1段速率变化的主要因素是 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
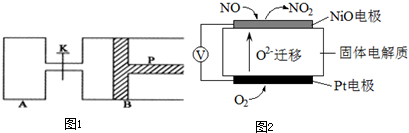
查看答案和解析>>
科目:高中化学 来源: 题型:
A、将容器体积变为10L,Z的平衡浓度变为原来的
| ||
| B、以X浓度变化表示的反应速率为0.001mol/(L?S) | ||
| C、若升高温度,X的体积分数增大,则该反应的△H>0 | ||
| D、若增大压强,则物质Y的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
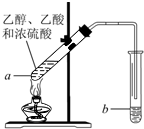 如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,
如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,查看答案和解析>>
科目:高中化学 来源: 题型:
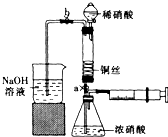 某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如下:
某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com