
【题目】有关物质的转化关系如下图所示。A是常见的无色液体,B是海水中最多的盐,D、F、J均为气体,C是石灰乳,L是石灰石,M具有漂白性,G、K均具有磁性,其中K为常见的金属单质。
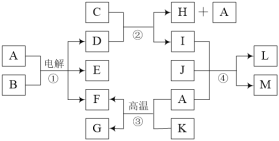
(1)E的化学式为____。
(2)A的电子式为____。
(3)写出反应③的化学方程式:____。
(4)写出反应④的离子方程式:____。
【答案】NaOH ![]() 4H2O+3Fe
4H2O+3Fe![]() Fe3O4+4H2 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
Fe3O4+4H2 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
【解析】
A是常见的无色液体,B是海水中最多的盐,则A为水,B为氯化钠,电解氯化钠溶液生成氢氧化钠、氢气和氯气;D、F、J均为气体,故E为氢氧化钠;根据K为常见的金属单质,与水在高温条件下反应,可推出F为氢气,G、K均具有磁性,G为四氧化三铁,K为铁单质;D为氯气;C是石灰乳,石灰乳与氯气反应生成氯化钙、次氯酸钙和水,I、J分别为次氯酸钙和二氧化碳,L是石灰石,M具有漂白性,M为次氯酸,据此分析。
A是常见的无色液体,B是海水中最多的盐,则A为水,B为氯化钠,电解氯化钠溶液生成氢氧化钠、氢气和氯气;D、F、J均为气体,故E为氢氧化钠;根据K为常见的金属单质,与水在高温条件下反应,可推出F为氢气,G、K均具有磁性,G为四氧化三铁,K为铁单质;D为氯气;C是石灰乳,石灰乳与氯气反应生成氯化钙、次氯酸钙和水,I、J分别为次氯酸钙和二氧化碳,L是石灰石,M具有漂白性,M为次氯酸。
综上可知,(1)E为氢氧化钠,其化学式为NaOH;
(2)A为水,其电子式为![]() ;
;
(3)反应③是铁在水蒸气中反应生成四氧化三铁和氢气,反应的化学方程式为:4H2O+3Fe![]() Fe3O4+4H2;
Fe3O4+4H2;
(4)反应④是二氧化碳通入次氯酸钙溶液中反应生成次氯酸、碳酸钙沉淀,反应的离子方程式为:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO。


科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,难溶于冷水,易溶于酸。其制备装置及步骤如下:
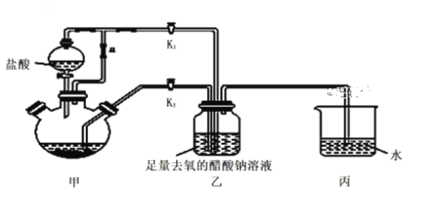
①检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液。
②关闭K2,打开K1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,将溶液转移至装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到3.76 g [Cr(CH3COO)2]2·2H2O
(1)三颈烧瓶中的Zn与盐酸生成H2的作用____________,还发生的另一个反应的离子方程式为______________。
(2)实现步骤③中溶液自动转移至装置乙中的实验操作为______________,当乙中析出红棕色沉淀,为使沉淀充分析出并分离,需采用的操作是___________ 、_________、洗涤、干燥。
(3)装置丙中导管口水封的目的是______________。
(4)若实验所取用的CrCl3溶液中含溶质6.34 g,则[Cr(CH3COO)2]2·2H2O (相对分子质量为376)的产率是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2FeSO4·7H2O ![]() Fe2O3+SO2↑+SO3↑+14H2O↑。用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是
Fe2O3+SO2↑+SO3↑+14H2O↑。用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是

A. 乙、丙、丁中可依改盛装无水CuSO4、Ba(NO3)2溶液、品红溶液
B. 实验时应先打开K,缓缓通入N2,再点燃酒精喷灯
C. 甲中残留固体加稀硫酸溶解,再滴加KSCN,溶液变红
D. 还应在丁装置后面连接盛有NaOH溶液的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是
A. 某溶液![]() 有白色沉淀,说明原溶液中有Cl-
有白色沉淀,说明原溶液中有Cl-
B. 某溶液![]() 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-
C. 某溶液![]() 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+
D. 某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐不仅是日常生活的必需品,也是重要的化工原料。工业上通过海水硒盐得到粗产品再进行精制以获得纯NaCl,精制过程如图所示:

提供的试剂:Na2CO3溶液,NaOH溶液,BaCl2溶液。
粗盐产品中含有的杂质主要有硫酸盐和MgCl2、CaCl2。
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,“一系列操作”中滴加试剂的先后顺序为___、NaOH、____。(填化学式)
(2)加入碳酸钠可以除去溶液中的___(填化学式,下同)和过量的___。写出Na2CO3发生反应的两个化学方程式:___,___。
(3)加入过量盐酸的作用是___。
(4)写出盐酸参与反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. MnO2+ 4HCl(浓)![]() MnCl2 +Cl2↑ + 2H2O中,氧化剂和还原剂物质的量之比为1∶4
MnCl2 +Cl2↑ + 2H2O中,氧化剂和还原剂物质的量之比为1∶4
B. 2H2S+ SO2=3S+2H2O中,氧化产物和还原产物物质的量之比为1∶1
C. 3S+ 6KOH=2K2S+ K2SO3+3H2O中,被氧化和被还原的硫元素物质的量之比为2∶1
D. Al2O3+N2+3C![]() 2AlN+3CO中,氧化剂和还原剂物质的量之比为1∶3
2AlN+3CO中,氧化剂和还原剂物质的量之比为1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中不同的化学键如右图,关于其在各类反应中断裂键的说明不正确的是
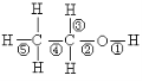
A. 和金属钠反应键①断裂
B. 和HBr在一定条件下反应时键②断裂
C. 和浓硫酸共热140℃时键①或键②断裂;170℃时键②③断裂
D. 在Ag催化下和O2反应键①③断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O![]() HS-+OH-。下列说法正确的是( )
HS-+OH-。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大B. 加入CuSO4固体,HS-浓度减小
C. 升高温度,c(HS-)/c(S2-)减小D. 加入NaOH固体,溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的有
① 3 mol单质Fe完全转化为Fe3O4,失去9NA个电子
② 标准状况下,11.2LCl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
③ 32gS8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
④常温常压下,0.5 mol Fe和足量浓硝酸混合,转移电子数为1.5NA
⑤ 1L0.1mol·L-1 NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
⑥浓硫酸(含1molH2SO4)与足量Cu加热发生反应生成0.5NA个SO2分子
⑦标准状况下,22.4 L N2和H2的混合气休中含有NA个原子
⑧23gNa与足量H2O反应完全后可生成NA个氢气分子
A. 一项B. 两项C. 三项D. 四项
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com