
| A. | 碘液 | B. | 银氨溶液 | C. | 碘液和银氨溶液 | D. | 碘液或银氨溶液 |
分析 淀粉在酶作用下水解生成葡萄糖,用新制的氢氧化铜悬浊液或银氨溶液可证明有无葡萄糖存在,说明淀粉已水解,根据淀粉遇碘变蓝,说明仍有淀粉存在,则证明淀粉已部分水解,据此分析解答.
解答 解:淀粉在酶作用下水解生成葡萄糖,证明淀粉部分水解,需要证明水解后的溶液中含有未水解的淀粉和水解产物葡萄糖;
用新制的氢氧化铜悬浊液或银氨溶液可证明有无葡萄糖存在,证明淀粉在酶作用下只部分发生了水解;
然后向水解后的溶液加碘水变蓝,则说明溶液中含有淀粉,证明其水解不完全,
所以需要的试剂为碘水、银氨试剂,故选C.
点评 本题考查了淀粉的性质实验,题目难度不大,明确淀粉的水解反应原理为解答关键,注意掌握醛基、淀粉的检验方,试题侧重基础知识的考查,培养了学生的化学实验能力.


科目:高中化学 来源: 题型:选择题
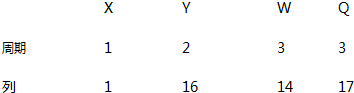
| A. | Y 的氢化物沸点高于 Q 的氢化物沸点 | |
| B. | 最高正价与最低负价之和为 0 的元素只有 W | |
| C. | 原子半径顺序为:r(W)>r(Q)>r(Y)>r(X) | |
| D. | X、Y、Q 三元素形成的分子中,原子最外层电子数之和最大为 32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有③ | B. | 只有④ | C. | ③④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
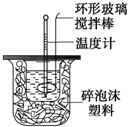 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
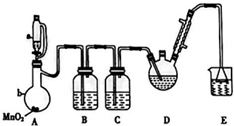 三氧乙醛(CCl3CHO)是生产农药、医药的重要中间体.实验室制备三氧乙醛的反应装置示意图(加热装置未画出)和有关数据如下:
三氧乙醛(CCl3CHO)是生产农药、医药的重要中间体.实验室制备三氧乙醛的反应装置示意图(加热装置未画出)和有关数据如下:| 物质 | C2H5OH | CCl3CHO | CCl3COOH | C6H5Cl |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )| A. | 平衡时A气体在两容器中体积分数可能相等 | |
| B. | 若x:y=1:2,则平衡时,M中的转化率:A>B | |
| C. | 若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% | |
| D. | 若x=1,y=3,则达到平衡时反应物的转化率N<M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCH4和CH3CH2OH的混合物所含分子数为NA | |
| B. | 常温常压下,16g14CH4所含中子数数目为8NA | |
| C. | 15.6gNa2O2和水完全反应转移的电子数为0.2NA | |
| D. | 0.1L3mol/L的NH4NO3溶液中含有的NH4+数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子由锌经导线流向Ag2O | |
| B. | 负极的电极反应为Zn-2e-═Zn2+ | |
| C. | 溶液中OH-向正极移动 | |
| D. | 随着电极反应的不断进行,电解质的碱性减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com