
分析 (1)根据元素守恒可判断有机化合物中一定含有C和H两种元素,根据生成8.8g的二氧化碳中C元素质量即为化合物中所含C元素质量、生成5.4g 的水中H元素质量即为化合物中所含H元素质量,对氧元素的确定要根据二氧化碳和水中的氧元素质量之和与氧气中氧元素的质量来分析,若前者大,则有机化合物有氧元素,两者相等,则有机化合物没有有氧元素,然后求出各自的物质的量,计算该物质中各元素的原子个数比;
(2)根据有机物的最简式和相对分子质量求出分子式;
(3)根据分子式结合同分异构现象写出结构简式;
(4)根据分子式结合氢原子种类写出结构简式;
(5)乙醇在浓硫酸加热的条件下反应可以得到乙烯,乙烯通过加聚反应生成聚乙烯;
(6)加成反应的原子利用率是100%,依稀可以和HX发生加成反应;
解答 解:(1)n(CO2)=$\frac{8.8g}{44g/mol}$=0.2 mol,
n(H2O)=$\frac{5.4g}{18g/mol}$=0.3 mol,反应中消耗O2的物质的量n(O2)=$\frac{6.72L}{22.4L/mol}$=0.3 mol,
则有机物中氧原子物质的量 n(O)=0.2 mol×2+0.3 mol×1-0.3 mol×2=0.1 mol,
所以该物质中C、H、O原子的个数比为0.2 mol:(0.3 mol×2):0.1 mol=2:6:1.
故答案为:2:6:1;
(2)因其相对分子质量为46,该物质中C、H、O原子的个数比为2:6:1,则其分子式为C2H6O,
故答案为:C2H6O;
(3)据A的分子式为C2H6O,A为饱和化合物,有机物A的结构为:CH3CH2OH或CH3OCH3,
故答案为:CH3CH2OH、CH3OCH3;
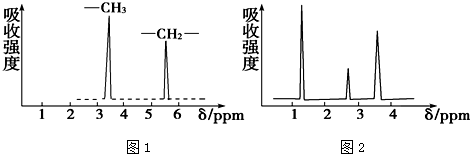
(4)根据图2可知,A分子内有3种氢原子,所以其结构简式为CH3CH2OH,
故答案为:CH3CH2OH;
(5)乙醇在一定条件下脱水可生成乙烯,乙烯可合成包装塑料聚乙烯,反应的化学方程式为:nCH2=CH2$\stackrel{催化剂}{→}$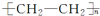 ,
,
故答案为:nCH2=CH2$\stackrel{催化剂}{→}$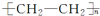 ;
;
(6)B为乙烯,原子利用率为100%,则可用乙烯与HCl反应制备氯乙烷,反应的化学方程式为:CH2=CH2+HCl$→_{△}^{催化剂}$CH3CH2Cl,
故答案为:CH2=CH2+HCl$→_{△}^{催化剂}$CH3CH2Cl.
点评 本题考查了有机物的分子式、结构简式确定的计算,题目难度中等,注意掌握确定有机物分子式、结构简式的方法,明确质谱仪中的质荷比、核磁共振氢谱中峰的含义为解答本题的关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
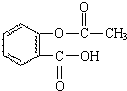 化学和环境保护、食品营养、材料应用等密切相关.
化学和环境保护、食品营养、材料应用等密切相关. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KN03 | B. | NH4NO3 | C. | CaC2 | D. | P4(白磷) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | 实验结论或目的 |  | |
| A | 浓盐酸 | KMnO4 | 石蕊试液 | 氯气的水溶液有酸性、漂白性 | |
| B | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
| C | 硝酸 | Na2CO3溶液 | Na2SiO3溶液 | 比较硝酸、碳酸、硅酸酸性强弱 | |
| D | 溴水 | FeBr3、苯 | AgNO3溶液 | 苯和溴水能发生取代反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、K-、CIO-、Fe2+ | B. | OH-、Na+、Mg2+、Br- | ||
| C. | Cu2+、H+、CI-、NO3- | D. | Na+、SiO32-、Ca2+、CI- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com