
分析 (1)先进行过量判断,然后根据方程式进行计算;
(2)先求出各自的物质的量然后代入公式C=$\frac{n}{V}$来解;
(3)先求出各自的物质的量然后代入公式C=$\frac{n}{V}$,求出氢离子的浓度,再根据pH=-lgc(H+)来解;
解答 解:(1)FeS的物质的量为$\frac{8.8g}{88g/mol}$=0.1mol,盐酸的物质的量为0.2L×2.0mol•L-1=0.4mol,根据方程式FeS+2H+═Fe2++H2S↑可判断盐酸过量,计算应以FeS的物质的量为基准,则共生成H2S 0.1mol.在溶液中溶解的物质的量为:0.10mol•L-1×0.2L=0.02mol,所以收集到的H2S气体的物质的量为0.08mol,其体积为:0.08mol×22.4L/mol=1.8L,
答:收集到的H2S气体的体积(标准状况)为1.8L;
(2)参加反应的FeS的物质的量0.1mol,根据方程式FeS+2H+═Fe2++H2S↑得Fe2+的物质的量为0.1mol,所以Fe2+的物质的量浓度为$\frac{0.1mol}{0.2L}$=0.5mol•L-1
答:溶液中Fe2+的物质的量浓度0.5mol•L-1.
(3)参加反应的FeS的物质的量0.1mol,根据方程式FeS+2H+═Fe2++H2S↑得消耗掉H+0.20 mol,反应前H+的物质的量为:2.0 mol•L-1×0.20 L=0.40 mol,剩余的H+的物质的量为0.40 mol-0.20 mol=0.20 mol,H+的物质的量浓度为$\frac{0.2mol}{0.2L}$=1.0mol•L-1
pH=-lgc(H+)=-lgc1=0
答:反应后溶液的pH为0.
点评 本题考查物质的量浓度的计算题目,难度不大,注意有关计算公式的运用.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.01 mol/L | B. | 0.017 mol/L | C. | 0.05 mol/L | D. | 0.50 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| B. | 改变压强(压缩气体或扩大容积),平衡不发生移动,反应放出的热量不变 | |
| C. | 升高温度,反应速率加快,反应放出的热量不变 | |
| D. | 若在原电池中进行,反应放出的热量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
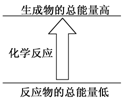
| A. | 镁片与盐酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl晶体的反应 | ||
| C. | 酸碱中和反应 | D. | 乙醇在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②①④③ | B. | ③②①④ | C. | ③①②④ | D. | ③①④② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取和草酸的性质,进行如下实验.
草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取和草酸的性质,进行如下实验.| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(S) (g) | 褪色时间(S) | ||
| C(mol•L-1) | V(mL) | C(mol•L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com