
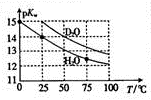
 Hz0与D20的pKw (pKw=-lgKw)与温度的关系如图所示,下列有关说法正确的是( )
Hz0与D20的pKw (pKw=-lgKw)与温度的关系如图所示,下列有关说法正确的是( )| A. | D20的电离过程为吸热过程 | B. | 25℃时,纯D20的pH等于7 | ||
| C. | 25℃时,pH=7的液体一定是纯H20 | D. | 常温下,向Dz0中加入DCI,pKw变大 |
分析 由H2O?H++OH-,水中氢离子和氢氧根离子的浓度相等,结合Kw等于氢离子和氢氧根离子浓度之积推断各选项.
A、根据图示:温度越高,pKw越小,所以Kw越大,据此回答;
B、根据25℃时,纯D20的pKw来计算其pH;
C、25℃时,pH=7的液体可以是纯H20、不水解的盐、醋酸铵等物质的溶液;
D、水的离子积只受温度影响,据此回答.
解答 解:A、根据图示:温度越高,pKw越小,所以Kw越大,得到D20的电离过程为吸热过程,故A正确;
B、根据25℃时,纯D20的pKw是15,所以其pH=7.5,故B错误;
C、25℃时,pH=7的液体可以是纯H20、不水解的盐、醋酸铵等物质的溶液,不一定只是纯水,故C错误;
D、水的离子积只受温度影响,常温下,向Dz0中加入DCI,pKw不变,故D错误.
故选A.
点评 本题通过对水的电离平衡常数影响因素、氢离子与氢氧根离子浓度的关系的考查,培养学生分析问题、解决问题的能力.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
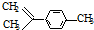 ,有关分析正确的是( )
,有关分析正确的是( )| A. | 一氯代物共有7种 | B. | 分子中所有碳原子一定在同一平面 | ||
| C. | 和 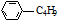 互为同分异构体 互为同分异构体 | D. | 1mol柠檬烯与H2反应最多消耗4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性 | B. | 还原性 | ||
| C. | 既无氧化性又无还原性 | D. | 既有氧化性又有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ | 向实验I中得到的溶液滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
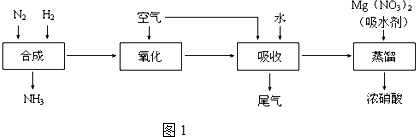
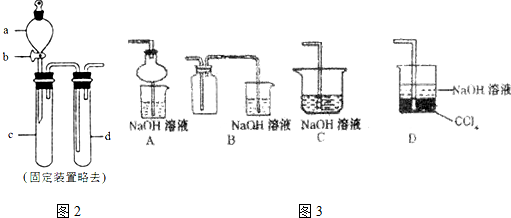
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
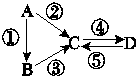 根据物质性质完成下列题型.
根据物质性质完成下列题型.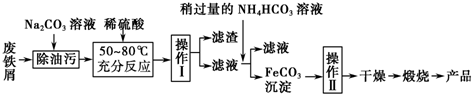
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
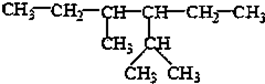 的系统命名为2,4-二甲基-3-乙基乙烷.
的系统命名为2,4-二甲基-3-乙基乙烷.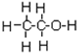 乙烯的电子式
乙烯的电子式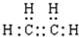
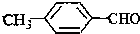 <
<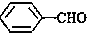
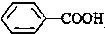 >CH3COOH(提示:类比酚和醇的酸性)
>CH3COOH(提示:类比酚和醇的酸性)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com