
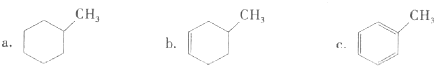
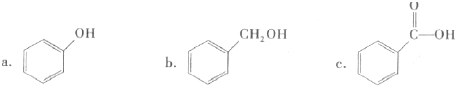
分析 ①含苯环,且只含C、H元素的烃为芳香烃;
②含苯环、-OH,且-OH与苯环直接相连的为酚;
③纤维素为多糖.
解答 解:①含苯环,且只含C、H元素的烃为芳香烃,则由图可知,只有c为芳香烃,故答案为:c;
②含苯环、-OH,且-OH与苯环直接相连的为酚,由图可知,a为酚,b为醇、c为羧酸,故答案为:a;
③a.油脂含-COOC-,为酯类物质;b.纤维素水解最终产物为葡萄糖,为多糖; c.蛋白质含CONH-,水解最终产物为氨基酸,则有机物属于糖类的是b,故答案为:b.
点评 本题考查有机物的官能团及分类,为高频考点,把握有机物的结构、官能团、物质类别为解答的关键,侧重分析与应用能力的考查,注意基本营养物质的结构,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 水溶液中:K+、Ca2+、C1-、NO${\;}_{3}^{-}$ | |
| B. | 空气:CH4、CO2、SO2、NO | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Br- | |
| D. | 高锰酸钾溶液:H+、Na+、SO${\;}_{4}^{2-}$、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水煤气 | B. | 焦炉煤气 | C. | 石油液化气 | D. | 高炉煤气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生铁比纯铁更易锈蚀 | |
| B. | 构成原电池的正极和负极必须是两种不同的金属 | |
| C. | 纯银器在空气中表面渐渐变暗是因为发生了原电池反应 | |
| D. | 充电电池的充放电次数有限是由它的工作原理所决定的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
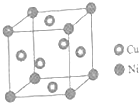 东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃料电池的电极包含活性物质,参与电极反应 | |
| B. | 氢氧燃料电池工作时发出蓝色火焰 | |
| C. | 铁在干燥的空气中不易生锈,在潮湿的空气中易生锈,主要是因发生电化腐蚀 | |
| D. | 温度一定时,催化剂不仅可以加快化学反应速率,而且可以改变反应物的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O2与18O2互为同分异构体 | |
| B. | 16O与18O核外电子排布方式不同 | |
| C. | 16O与18O的质量数相同 | |
| D. | 标准状况下,1.12 L 16O2和1.12 L 18O2均含0.1 NA 个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
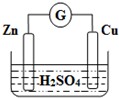
| A. | Zn是负极,Cu是正极 | B. | 稀硫酸溶液中H+移向Zn极 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 该装置能将电能转变为化学能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com