
| A. | 0.1 mol•Lˉ1BaCl2溶液 | B. | 澄清石灰水 | ||
| C. | 稀盐酸 | D. | pH试纸 |
分析 Na2CO3、NaHCO3均与石灰水反应生成白色沉淀,碳酸钠与氯化钡反应生成白色沉淀,二者溶液的碱性不同,且与酸反应生成气体的快慢不同,以此来解答.
解答 解:A.与氯化钡反应生成白色沉淀的为碳酸钠,无现象的为碳酸氢钠,故A不选;
B.Na2CO3、NaHCO3均与石灰水反应生成白色沉淀,不能鉴别,故B选;
C.与盐酸反应生成气体快的为碳酸氢钠,慢的为碳酸钠,故C不选;
D.pH值大的为碳酸钠,小的为碳酸氢钠,可鉴别,故D不选;
故选B.
点评 本题考查物质的检验和鉴别,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同及发生的反应,题目难度不大.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:解答题
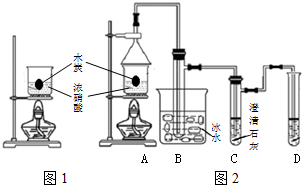 浓硝酸是一种常见的酸,加热或见光易分解生成NO2.某实验小组欲探究碳与浓硝酸的反应情况.实验装置如图.回答下列问题:
浓硝酸是一种常见的酸,加热或见光易分解生成NO2.某实验小组欲探究碳与浓硝酸的反应情况.实验装置如图.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙一定是氯化钾溶液 | B. | 甲一定是氢氧化钡溶液 | ||
| C. | 丙不可能是碳酸钠溶液 | D. | 丁只能是硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用丁达尔效应可以区分溶液和胶体 | |
| B. | 加热饱和FeCl3溶液可制取Fe(OH)3胶体 | |
| C. | 利用焰色反应可以鉴别NaCl、KNO3、Na2SO4 | |
| D. | 用Ca(OH)2溶液可以区分Na2CO3和NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两溶液的物质的量浓度相同 | |
| B. | 两溶液的c(H+)相同 | |
| C. | 等体积的两溶液分别与足量Zn反应,产生H2的量不同 | |
| D. | 将两溶液均稀释100倍后,pH不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用小苏打治疗胃酸过多:CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 用FeCl3溶液腐蚀印刷电路板上铜箔:Fe3++Cu═Fe2++Cu2+ | |
| D. | 钠与氢氧化钠溶液反应:2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
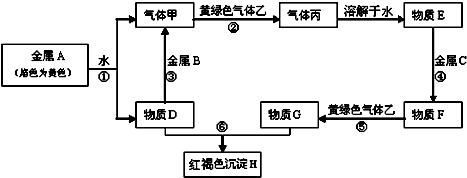
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com