
一定温度下,将NO2与SO2以体积比为1:2置于密闭容器中发生NO2(g)+SO2(g) SO3(g)+NO(g) △H= -41.8 kJ•mol-1,测得上述反应平衡时NO2与SO2体积比为1:6,下列说法正确的是( )
SO3(g)+NO(g) △H= -41.8 kJ•mol-1,测得上述反应平衡时NO2与SO2体积比为1:6,下列说法正确的是( )
A.平衡常数K=8/3
B.达到平衡后NO2和SO2的转化率相等
C.SO3和NO的体积比保持不变可以证明达到平衡状态
D.每消耗1molSO3的同时生成1molNO2
科目:高中化学 来源:2016届上海市十一校高三上学期12月联考化学试卷(解析版) 题型:选择题
在通常条件下,下列各组物质的性质排列正确的是
A.密度:CH3CH2CH2Cl>CH3CH2Cl>CH3Cl
B.热稳定性:HF>H2O>NH3
C.还原性:HF>HCl>HBr>HI
D.水溶性: HCl>H2S> SO2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上学期12月月考化学试卷(解析版) 题型:选择题
关于胶体的叙述,不正确的是
A.有色玻璃是固溶胶
B.雾、云、烟都是气溶胶
C.用滤纸能把胶体中的分散质与分散剂分离
D.胶粒大小在1nm~100 nm之间
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(实验班)化学试卷(解析版) 题型:实验题
某化学活动小组按下图所示流程由粗氧化铜样品(含少量氧化亚铁及不溶于酸的杂质)制取无水硫酸铜。
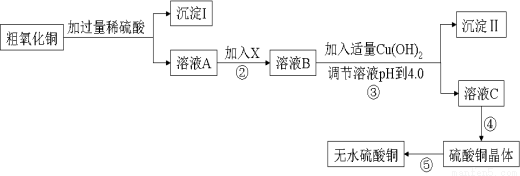
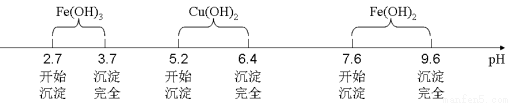
已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:
请回答下列问题:
(1)在整个实验过程中,下列实验装置不可能用到的是 (填序号)
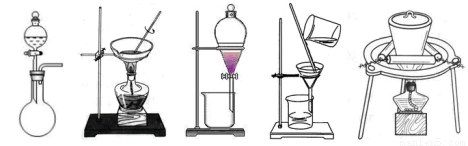
① ② ③ ④ ⑤
(2)溶液A中所含溶质为 ;
(3)物质X应选用 (填序号),沉淀II的主要成分是
①氯水 ②双氧水 ③铁粉 ④高锰酸钾
(4)从溶液C中制取硫酸铜晶体的实验操作为 。
(5)用“间接碘量法”可以测定溶液A中Cu2+(不含能与I-发生反应的杂质)的浓度。过程如下:
第一步:移取10.00mL溶液A于100mL容量瓶,加水定容至100mL。
第二步:取稀释后试液20.00mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质。
第三步:以淀粉溶液为指示剂,用0.05000mol·L-1的Na2S2O3标准溶液滴定,前后共测定三组。达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:
(已知:I2+2S2O32-===2I-+S4O62-)
滴定次数 | 第一次 | 第二次 | 第三次 |
滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
滴定滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
①CuSO4溶液与KI的反应的离子方程式为 。
②滴定中,试液Na2S2O3应放在  (填“酸式滴定管”或“碱式滴定管”),判断滴定终点的依据是 。
(填“酸式滴定管”或“碱式滴定管”),判断滴定终点的依据是 。
③溶液A中c(Cu2+)= mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(实验班)化学试卷(解析版) 题型:选择题
下列物质的水溶液因水解而呈碱性的是
A.Ba(OH)2 B.FeCl3 C.NaHSO4 D.CH3COONa
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高二上段考文化学试卷(解析版) 题型:填空题
在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
C | D | ||||||||
A | B | E | F | ||||||
(1)画出D的原子结构示意图 ;
(2)写出C的最高价氧化物的电子式 ,该化合物所含化学键为 ;
(3)E和F分别形成的气态氢化物中最稳定的是 (填写氢化物的化学式);
(4)A最高价氧化物的水化物的化学式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二上学期期末化学试卷(解析版) 题型:选择题
在密闭容器中A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示。已知v(A)、v(B)、v(C)之间有以下关系2v(B)=3v(A),3v(C)=2v(B)。则此反应可表示为( )。
A.2A+3B=2C B.A+3B2=C C.3A+B=2C D.A+B=C
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上期末考试化学试卷(解析版) 题型:填空题
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)═CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ/mol
CH3CH=CH2(g)═CH4(g)+HC≡CH(g)△H2=+32.4kJ/mol
则相同条件下,反应C3H8(g)═CH3CH=CH2(g)+H2(g)的△H= kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时CO32-移向电池的 (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH =5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二步电离,则H2CO3 HCO3-+H+的平衡常数K1= mo1/L。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= mo1/L。(已知10-5.60=2.5×10-6)
(4)常温下,0.1 mo1/L NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用简要的文字明)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com